Gli usi del vanadio e i suoi impieghi in base agli stati di ossidazione
Questo contenuto è tratto da una borsa di studio dello Stanford Advanced Materials College del 2025 presentata da Addison Boyle.
Introduzione
Il vanadio fa parte dei metalli di transizione; il suo numero atomico è 23. Ha un'abbondanza nella crosta terrestre di circa (0,02%) simile a quella dello zinco.1 Nonostante la sua abbondanza, non ha ricevuto molta attenzione fino agli ultimi 50 anni. Le ricerche hanno dimostrato che il vanadio potrebbe avere uno scopo biologico attraverso lo ione vanadato.2 Esistono almeno 6 diversi stati di ossidazione; il vanadio esiste principalmente in +3, +4 e +5. Quando è isolato, ciascuno degli stati di ossidazione presenta un colore diverso. V4+ è blu, V3+ è verde e V2+ è viola.3 Queste ossidazioni sono anche le più rilevanti per i sistemi biologici.4
Il vanadio nel sangue:
Questi stati di ossidazione del vanadio sono importanti perché possono andare incontro a reazioni redox.4 La stabilità si basa sulla legatura, sul solvente e sul pH.2 Dal punto di vista biogenico, ciò significa che esistono agenti riducenti che possono convertire il vanadio in stati di ossidazione inferiori.4 Questo processo dipende dal pH: quando il pH aumenta, i potenziali redox diminuiscono.4 Quando viene assunto sotto forma di farmaco, entra nel flusso sanguigno ed entra nei costituenti del siero del sangue.4 La reazione con il vanadio determina la speciazione del vanadio.1
In condizioni leggermente acide, il V(III), quando si forma, assomiglia ai sistemi biologici esistenti.1 Nel plasma sanguigno potrebbero essere presenti agenti riducenti che potrebbero portare alla stabilizzazione del V(III) consentendo la formazione di specie V(III)2-hTF.1Questespecie assomigliano al Fe(III) 2-hTF, che viene riconosciuto dai recettori cellulari.1 Questo può avvenire quando V(III) o Fe(III) sono attratti da hTF se V(IV)O nel plasma sanguigno è disponibile, allora una riduzione a V(III) potrebbe essere favorevole dal punto di vista del guadagno di energia.1 Il legame di V(III) ha un logK 20, mentre se V(IV)O+2 ha un logK 13.1 Questa reazione deve avvenire in condizioni di lieve acidità.1
Si è visto che altri stati di ossidazione del vanadio (V(IV) e V(V)) possono subire uno scambio di ligandi e un'interconversione redox.1 I ligandi a bassa massa molecolare sono il lattato e il citrato, mentre quelli ad alta massa molecolare sono l'hTF, l'albumina e l'immunoglobulina G.1 Come nel V(III), il V(IV) e il V(V) reagiscono bene a causa dei residui dei siti di legame del Fe(III) dell'hTF.1 Poiché il Fe(III) 2-hFT è riconosciuto dai recettori cellulari per l'endocitosi.1 Questo potrebbe essere possibile anche per i complessi V(IV) e V(V).1 Quando il V(IV)OSO4 e l'apo-hTF sono incubati è dimostrato che corrispondono all'hTF.1 È anche dimostrato che il rapporto di formazione è inferiore a quello del Fe(III) 2hTF.1Si è visto che i complessi VIVO e VIVO-carrier, insieme a V(V) come monovanadato, potrebbero legarsi all'holo-hTF, che è l'agente di trasporto all'interno del sangue.1 Ciò significa che il vanadio potrebbe essere presente nel plasma sanguigno e passare attraverso l'endocitosi quando l'holo entra nelle cellule.1
Vanadato:
Esistono 3 tipi principali di reazioni che possono essere effettuate con il vanadato in chimica acquosa: reazioni di autocondensazione, reazioni di coordinazione e reazioni redox.4
Per le reazioni di condensazione, gli anioni del vanadato vengono protonati dagli oligomeri in un ambiente leggermente acido per renderlo più favorevole.4 Questo è fondamentale per il funzionamento delle cellule a causa del modo in cui il pH influisce sui diversi organelli.4 Nelle cellule tumorali è stato dimostrato che hanno un pH elevato degli organelli.4 Questo potrebbe significare che il vanadato potrebbe essere utilizzato per trovare le cellule tumorali con il pH elevato.4 Questo potrebbe essere fatto con una serie di oligomeri di vanadato in un ambiente acido.4
Poiché il vanadato presenta analogie con il fosfato, il vanadato ha iniziato a essere utilizzato nelle reazioni di coordinazione, ma è ancora per lo più allo stadio di provetta, il che significa che la maggior parte delle reazioni coordinate sono teoriche.4 Il fosfato è importante per i sistemi biologici ed è coinvolto in molti sistemi biologici di riconoscimento e biocatalitici.1 Dove il VO43- ha una somiglianza strutturale ed elettronica con il PO43- Fig 1.4 I complessi vanadati hanno geometrie trigono-bipiramidali a 5 coordinate, che corrispondono agli stati di transizione a 5 coordinate che si presume si formino nella reazione degli enzimi fosfato-dipendenti Fig 1.1 Sebbene ci possano essere ligandi mono- e polidentati, quelli utilizzati principalmente sono gli esteri di vanadato e le anidridi di vanadato, a causa della loro analogia con il fosfato. 4 Con la modellazione al computer, la maggior parte del vanadato era sotto forma di H2VO4- e HVO42- quando si escludevano le proteine, mentre quando si includevano le proteine, la maggior parte del vanadio era legata alla transferrina.4 Quando il complesso metallico del vanadato è stabilizzato da ligandi, aumenta la possibilità di riduzione.4 Questo porta a reazioni di coordinazione che tendono alla riduzione nei sistemi biologici.4
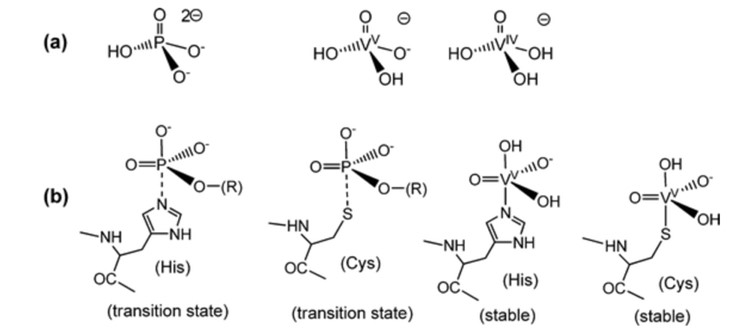
Fig. 1. Confronto tra fosfati e vanadato con stati di transizione e stabilità.5
Nelle reazioni redox nei sistemi biologici, gli stati di ossidazione che interessano il vanadio sono +3, +4 e +5.4 La maggior parte della riduzione del vanadato avviene a V(IV) da V(V).4 Questo tipo di reazione avviene in una varietà di biomolecole, specialmente negli organelli.4 Viene anche usato come tampone per le proteine fosfotirosiliche.4 Questo porta all'intervento nella via di segnalazione dell'insulina.4 Può essere utilizzato nel trattamento del diabete perché, una volta legato al sito attivo dell'enzima, il vanadato non viene rilasciato facilmente come il fosfato.1 Questo blocca il sito dal fosfato, portando a un'inibizione dell'enzima.1 Ci sono degli svantaggi nell'uso del vanadato per trattare il diabete, come lo stress ossidativo indotto dal vanadio, i problemi di tossicità globale, gli effetti sul sistema immunitario e l'infiammazione.1
Ricerca sul cancro:
Le proprietà del vanadio sono state studiate per i loro effetti chemiopreventivi e antitumorali nella lotta contro il cancro.1 I test sembrano essere principalmente nelle fasi di sperimentazione animale e su linee cellulari maligne.1 Il dicloruro di vanadene e diversi perossovanadati sono i principali composti di vanadio che sono stati utilizzati.1 Il dicloruro di vanadocene è solubile in acqua e a pH 7 gli ioni cloruro vengono sostituiti conH2O, dando origine a V(C5H5)2]2+.1 Si è visto che si lega al DNA, causando un diverso comportamento del cisplatino.1 Inoltre, ha dimostrato una tossicità limitata, nessun trasferimento attraverso la barriera ematica e non viene rilevato nel cervello.1 Gli obiettivi delle proprietà antitumorali del vanadio sono l'interruzione del metabolismo cellulare, le vie di trasduzione del segnale e l'interruzione della proliferazione cellulare.1 Ci sono state preoccupazioni circa le diverse risposte e la sicurezza del vanadio, che hanno portato a una mancanza di ricerca clinica.1 Con queste preoccupazioni in mente, si sta ancora facendo ricerca.1 I sistemi V(V)-mhcpe sono stati testati in vitro e hanno ottenuto risultati più tossici per le cellule tumorali che per quelle non tumorali.1 I complessi V(IV)- che hanno come ligandi i derivati 1-10-fenantrolina e i complessi V(IV)O-dppz hanno mostrato proprietà antitumorali Fig. 2, soprattutto contro la leucemia.1
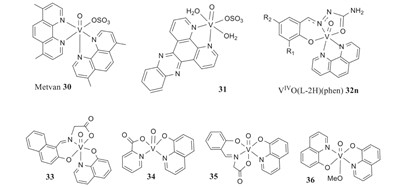
Fig. 2. Rappresentazione delle proprietà antitumorali dei composti vanadati, con stabilità del tampone a pH 7,1.
Amavadin:
Esiste un fungo che accumula vanadio chiamato Amanita muscaria, o mosca agarica.6 Un fungo tipico contiene meno di 0,5 mg di V kg-1, ma l'A. muscaria può contenere 100 mg di V kg-1.6 Le parti del corpo del fungo che contengono vanadio sono il gambo, la pelle del cappello, la polpa del cappello, le branchie, le spore e il bulbo.6 La concentrazione più alta di vanadio si trova nel bulbo, con 1000 mg V kg-1.6 Questa parte del fungo si trova nella parte più bassa del gambo, rendendola la più soggetta alla contaminazione da parte del suolo.6 Osservando il suolo superiore, la mediana del vanadio era di 60 mg kg-1, con un intervallo compreso tra 1,28 e 537 mg kg-1.6 Il vanadio trovato nell'A. muscaria era carico negativamente ed è stato chiamato amavadin Fig 3 da Bayer e Kneifel.6 Attraverso la spettroscopia di risonanza paramagnetica elettronica (EPR) si scoprì che lo stato di ossidazione del vanadio era +4.6 Gli spettri EPR indicavano anche che le diverse parti del fungo contenevano lo stesso composto amavadin.6 Si tratta di 2 ligandi tetradentati, mostrati nella Fig. 3, che possono coordinarsi al centro del vanadio, creando 2 isomeri che appaiono in miscela quasi uguale nell'amavadin sintetico e naturale.6
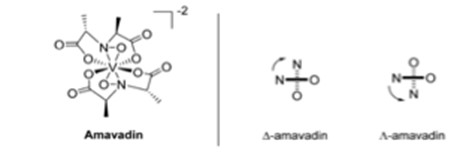
Fig. 3. Struttura dell'amavadina, con gli isomeri D e L.6
L'ossidazione di V(IV) a V(V) è reversibile nell'amavadina, il che significa che potrebbe avere proprietà catalitiche.6 È stato riscontrato che il complesso catalizza un'ampia gamma di reazioni.6 Ciò ha portato alla sintesi di diversi analoghi dell'amavadina con diversi centri di ioni metallici o ligandi modificati.6 Quando l'amavadina è stata sintetizzata da A. muscaria, si è scoperto che esistevano diversi complessi di vanadio, il più importante dei quali era l'acetato di vanadile.6 Il solido è stato trovato con il 26% (peso/peso) di acetato di vanadile e il 74% (peso/peso) di amavadina.6
Conclusioni
In conclusione, è stato dimostrato che il vanadio ha molteplici usi nei sistemi biologici. Dal trattamento del cancro ai funghi. La ricerca ha analizzato i diversi stati di ossidazione e il modo in cui possono essere ridotti nei sistemi biologici, come il sangue o le cellule. Gli stati di ossidazione primari del vanadio sono +3, +4 e +5. I leganti solitamente associati al vanadio sono complessi di ossigeno, in particolare il vanadato e l'acetato di vanadile. Ci sono ancora altre ricerche da fare sul vanadio e sugli effetti che avrà sulla comunità scientifica.
Riferimenti:
1. J.Costa Pessoa, Journal of Inorganic Biochemistry, 2015, 147, 4-24
2. A. Butler, e C. J. Carrano, Coordination Chemistry Reviews, 1991, 109, 61-65
3. D. Rehder, Bioinorganic Vanadium Chemistry, Wiley, Incorporated, New York, 2008.
4. X. Yang e K. Wang, in Progress in Molecular and Subcellular Biology, eds. W. E. G. Muller, P. Jeanteur, R. E. Rhoads, D. Ugarkovic e M. R. Custodio. Springer, Manz, Germania, 2013, cap. 1, pp 1-19.
5. D. Rehder, Metallomics, 2015, 7, 732
6. S. Braeuer, M. Walenta, L. Steiner e W. Goessler, Royal Society of Chemistry, 2021, 36, 954-967.

 Bar
Bar
 Perline e sfere
Perline e sfere
 Bulloni e dadi
Bulloni e dadi
 Crogioli
Crogioli
 Dischi
Dischi
 Fibre e tessuti
Fibre e tessuti
 Film
Film
 Fiocco
Fiocco
 Schiume
Schiume
 Lamina
Lamina
 Granuli
Granuli
 Nidi d'ape
Nidi d'ape
 Inchiostro
Inchiostro
 Laminato
Laminato
 Grumi
Grumi
 Maglie
Maglie
 Film metallizzato
Film metallizzato
 Piatto
Piatto
 Polveri
Polveri
 Asta
Asta
 Lenzuola
Lenzuola
 Cristalli singoli
Cristalli singoli
 Bersaglio di sputtering
Bersaglio di sputtering
 Tubi
Tubi
 Lavatrice
Lavatrice
 Fili
Fili
 Convertitori e calcolatori
Convertitori e calcolatori
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


