Catalizzatori di metalli preziosi: L'amplificatore di prestazioni - Il supporto
Capitolo 1: Introduzione
Un catalizzatore di metalli preziosi è un materiale in grado di alterare la velocità di una reazione chimica senza essere consumato nei prodotti finali. Sebbene quasi tutti i metalli preziosi possano fungere da catalizzatori, i più utilizzati sono il platino, il palladio, il rodio, l'argento e il rutenio, con il platino e il rodio che hanno le applicazioni più ampie. I loro orbitali d-elettronici parzialmente riempiti adsorbono prontamente i reagenti sulla superficie con una moderata forza di legame, facilitando la formazione di "composti attivi" intermedi e garantendo così un'elevata attività catalitica. Grazie a proprietà superiori come la resistenza alle alte temperature, all'ossidazione e alla corrosione, sono diventati tra i materiali catalitici più importanti.
I catalizzatori di metalli preziosi sono indispensabili in numerosi settori chiave grazie alla loro eccezionale attività catalitica e selettività. Nella bonifica ambientale, sono ampiamente utilizzati nei sistemi di depurazione dei gas di scarico degli autoveicoli e nei processi di combustione industriale per convertire efficacemente inquinanti tossici come il monossido di carbonio, gli ossidi di azoto e i composti organici volatili in gas innocui, riducendo in modo significativo le emissioni. Svolgono inoltre un ruolo fondamentale in altre aree di protezione ambientale, come la purificazione dell'aria e il trattamento delle acque reflue. Nella produzione industriale, sono fondamentali per la sintesi chimica, aumentando la velocità di reazione e la selettività dei prodotti attraverso reazioni catalizzate come l'idrogenazione, l'ossidazione e la carbonilazione. Inoltre, nel settore energetico all'avanguardia, i catalizzatori di metalli preziosi sono la pietra miliare delle tecnologie energetiche a idrogeno, parte integrante della produzione di idrogeno, del funzionamento delle celle a combustibile e dello stoccaggio dell'idrogeno, facendo così progredire la conversione e l'utilizzo di energia pulita.
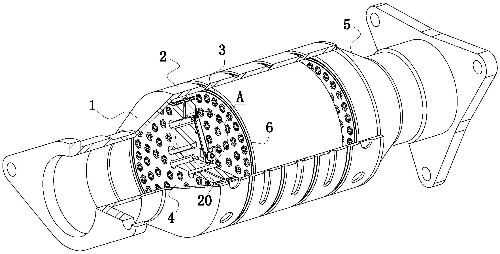
Fig. 1 Schema strutturale del convertitore catalitico a tre vie per autoveicoli
Tuttavia, gli svantaggi intrinseci dei metalli preziosi - la loro scarsità globale, il costo elevato e la suscettibilità alla disattivazione tramite sinterizzazione, lisciviazione e avvelenamento - ne limitano fortemente l'applicazione commerciale su larga scala. La chiave per affrontare queste sfide non risiede nei metalli preziosi in sé, ma nelle loro "fondamenta": il supporto. La moderna scienza catalitica rivela che il supporto è ben lungi dall'essere un'impalcatura fisica inerte; è una piattaforma multifunzionale e un partner sinergico fondamentale per superare i limiti dei metalli preziosi. Il suo valore fondamentale si manifesta in due aspetti chiave:
Il supporto, con la sua elevata superficie specifica e l'abbondanza di difetti superficiali, fornisce "siti di ancoraggio" sicuri per le nanoparticelle di metalli preziosi o anche per singoli atomi, consentendo una dispersione a livello atomico. Questo non solo massimizza l'esposizione dei siti attivi, migliorando significativamente l'efficienza di utilizzo degli atomi, ma previene efficacemente la migrazione e l'agglomerazione (sinterizzazione) delle particelle ad alte temperature attraverso vincoli fisici spaziali e forti interazioni, migliorando fondamentalmente la stabilità del catalizzatore.
Esistono profonde interazioni tra il supporto e il metallo prezioso. Attraverso effetti elettronici (ad esempio, interazioni forti metallo-supporto, SMSI), il supporto può modulare la densità della nuvola di elettroni del metallo prezioso, ottimizzando la sua forza di adsorbimento per i reagenti, migliorando così l'attività catalitica intrinseca e la selettività. Inoltre, l'acidità/basicità di superficie o le proprietà redox intrinseche del supporto possono catalizzare sinergicamente le reazioni con i siti attivi del metallo prezioso, consentendo percorsi di reazione complessi irraggiungibili dai singoli componenti, costruendo collettivamente efficienti sistemi catalitici bifunzionali.
Capitolo 2: Funzioni e meccanismi fondamentali del supporto
Nella progettazione di catalizzatori a base di metalli preziosi, il supporto non è un semplice recipiente di reazione passivo, ma un componente chiave che svolge molteplici ruoli attivi. I suoi meccanismi funzionali influenzano profondamente le prestazioni finali del catalizzatore e si manifestano principalmente in quattro aree:
1. Dispersione e stabilizzazione
La funzione principale del supporto è quella di fungere da "ancoraggio" per le nanoparticelle di metalli preziosi. Un'elevata area superficiale specifica (ad esempio, centinaia di m2/g) fornisce numerosi siti di caricamento, consentendo al metallo prezioso di essere altamente disperso a livello nanometrico o addirittura atomico, massimizzando così l'esposizione dei siti attivi e migliorando l'efficienza di utilizzo dell'atomo. Senza supporto, le nanoparticelle di metalli preziosi, a causa della loro elevata energia superficiale, migrano facilmente, si agglomerano e sinterizzano a temperature elevate, con conseguente drastica riduzione dell'area superficiale attiva e disattivazione. Inoltre, la struttura dei pori di molti supporti può creare un effetto di confinamento, limitando le particelle metalliche all'interno delle nanocavità o degli interstrati, creando così dei "nano-reattori", che ne ostacolano fisicamente il movimento e la crescita, migliorando ulteriormente la stabilità termica.

Fig. 2 Materiali porosi
2. Effetti elettronici
Tra il supporto e il metallo prezioso esistono profonde interazioni elettroniche, in particolare la Strong Metal-Support Interaction (SMSI). Prendendo come esempio il sistema Pt/TiO2, dopo un trattamento di riduzione ad alta temperatura, alcuni Ti4+ sulla superficie del TiO2 si riducono e migrano a coprire la superficie delle nanoparticelle di Pt, formando uno strato di sub-ossido. Questo processo è accompagnato da un trasferimento di elettroni dal TiO2 al Pt, che altera la densità della nuvola di elettroni del Pt e di conseguenza ne modula la forza e la modalità di adsorbimento per le molecole reagenti (ad esempio, CO, O2). Questo "controllo a distanza" tramite effetti elettronici può migliorare significativamente l'attività catalitica e la selettività per reazioni specifiche e persino conferire resistenza all'avvelenamento.
3. Catalisi sinergica
Molti supporti non sono inerti; le loro superfici possiedono siti acidi/basici o siti cataliticamente attivi intrinseci, che consentono una catalisi sinergica con il metallo prezioso, costituendo un meccanismo "bifunzionale". Ad esempio, nel reforming catalitico nella raffinazione del petrolio, il Pt nel catalizzatore Pt/γ-Al2O3 è responsabile dell'idrogenazione/deidrogenazione delle olefine, mentre i siti acidi sulla superficie di γ-Al2O3 facilitano l'isomerizzazione dei carbocationi; le due funzioni lavorano insieme per ricostruire le molecole di idrocarburi. Un altro esempio è rappresentato dalle reazioni anodiche delle celle a combustibile, dove le specie RuOH nei catalizzatori PtRu/C promuovono l'attivazione dell'acqua, fornendo specie OH ai siti Pt adiacenti per ossidare il CO, risolvendo il problema dell'avvelenamento del catalizzatore Pt da parte del CO.
Fig. 3 Catalisi cooperativa organica piccola molecola/metallo
4. Trasferimento di massa e calore
La struttura fisica del supporto determina l'efficienza di trasporto di reagenti e prodotti. La regolazione precisa della struttura porosa (comprese le dimensioni dei pori, il volume dei pori e la connettività) ottimizza i tassi di diffusione, evitando perdite di efficienza di reazione dovute a limitazioni del trasferimento di massa. I macropori favoriscono un rapido trasferimento di massa, i mesopori sono adatti per caricare nanoparticelle e facilitare le reazioni, mentre i micropori possono consentire la selettività della forma. Allo stesso tempo, i supporti eccellenti possiedono un'elevata stabilità termica e conducibilità termica, che consente loro di sopportare ambienti di reazione esotermici ad alta temperatura, di rimuovere rapidamente il calore di reazione e di prevenire il collasso della struttura del catalizzatore e la sinterizzazione del componente attivo causati dal surriscaldamento locale.
Capitolo 3: Principali tipi di supporti per catalizzatori di metalli preziosi e loro caratteristiche
1. Supporti di ossido
I supporti ossidici sono la categoria più studiata e ampiamente applicata.
γ-Al2O3: Conosciuto come il supporto "cavallo di battaglia", i suoi vantaggi includono un'elevata area superficiale specifica, un'adeguata acidità superficiale e una buona resistenza meccanica. Queste proprietà lo rendono ideale per i catalizzatori automobilistici a tre vie (caricamento di Pt, Pd, Rh) e per i catalizzatori di idrodesolforazione (caricamento di Pd).
SiO2: Possiede tipicamente una superficie neutra e un'elevata area superficiale specifica. La sua inerzia superficiale significa che non interferisce con l'attività intrinseca del metallo prezioso. Il SiO2 mesoporoso sintonizzabile può essere preparato con metodi di templatura e trova largo impiego nelle reazioni di idrogenazione e ossidazione selettiva.
TiO2: Oltre alla sua elevata area superficiale specifica, la sua caratteristica più significativa è la capacità di formare forti interazioni metallo-supporto (SMSI) con i metalli preziosi, migliorando notevolmente le prestazioni catalitiche. Inoltre, il TiO2 è un eccellente semiconduttore fotosensibile; se combinato con Au, Pt, ecc. mostra un grande potenziale nella fotocatalisi per la scissione dell'acqua e la degradazione degli inquinanti.
CeO2: Possiede un'esclusiva capacità di immagazzinare ossigeno (OSC), che gli consente di passare rapidamente dall'atmosfera ossidante a quella riducente attraverso il ciclo Ce4+/Ce3+, regolando efficacemente la concentrazione di ossigeno nell'ambiente di reazione. Questa caratteristica lo rende indispensabile nella purificazione dei gas di scarico degli autoveicoli (come co-catalizzatore) e nelle reazioni redox.
Tabella 1: Confronto tra le principali caratteristiche dei supporti di ossido
|
Tipo di supporto |
Area superficiale specifica |
Proprietà della superficie |
Caratteristiche principali |
Applicazioni tipiche |
|
γ-Al2O3 |
Alta |
Debolmente acido |
Elevata resistenza meccanica, buona stabilità termica |
Pulizia degli scarichi auto, idrotrattamento |
|
SiO2 |
Alto |
Neutro |
Dimensione dei pori regolabile, superficie inerte |
Idrogenazione selettiva, ossidazione |
|
TiO2 |
Medio |
Anfotero |
SMSI, Attività fotocatalitica |
Fotocatalisi, ossidazione del CO |
|
CeO2 |
Medio |
Di base |
Eccellente capacità di immagazzinare ossigeno |
Catalizzatori a tre vie, reazione di spostamento acqua-gas |
2. Supporti in materiale di carbonio
I materiali di carbonio si distinguono per la loro conduttività e diversità strutturale.
Carbonio attivato: Presenta un'area superficiale specifica estremamente elevata e abbondanti gruppi funzionali superficiali (ad esempio, -OH, -COOH), che lo rendono facile da modificare e da caricare sui metalli. Grazie al suo basso costo, è ampiamente utilizzato nelle reazioni in fase liquida (ad esempio, idrogenazione chimica fine) e nell'elettrocatalisi.
Nanotubi di carbonio/Grafene: questi nuovi materiali di carbonio possiedono una struttura unica di carbonio ibridato sp², una conducibilità estremamente elevata e canali regolari per i pori. Non solo inducono effetti elettronici con i metalli preziosi attraverso la coniugazione π-π, ma assicurano anche un rapido trasferimento di elettroni durante l'elettrocatalisi grazie alla loro eccezionale conduttività, dimostrando così prestazioni eccezionali in campi come le celle a combustibile (ad esempio, Pt/CNTs per la riduzione dell'ossigeno) e l'elettrolisi dell'acqua.
3. Supporti di zeolite
Le zeoliti sono alluminosilicati cristallini caratterizzati principalmente da sistemi di canali microporosi ordinati e da un'acidità regolabile.
Selettività di forma: Le dimensioni dei pori su scala molecolare (tipicamente <2 nm) consentono il passaggio selettivo di reagenti e prodotti in base alle dimensioni e alla forma, consentendo una catalisi selettiva in base alla forma. Ad esempio, nell'idrofinitura del diesel catalizzata da Pt/zeolite, gli alcheni a catena retta possono essere idrogenati selettivamente mentre gli alcani ramificati vengono trattenuti.
Forte acidità ed effetto di confinamento: I loro forti centri acidi, combinati con il confinamento delle particelle metalliche all'interno dei micropori, li rendono eccellenti in reazioni come l'isomerizzazione degli alcani e l'aromatizzazione.
4. Altri supporti innovativi
Con i progressi delle nanotecnologie, una serie di nuovi supporti mostra un grande potenziale.
Quadri metallo-organici (MOF): Composti da ioni metallici e leganti organici, vantano un'area superficiale specifica elevatissima e ambienti di pori progettabili a livello atomico, che li rendono piattaforme ideali per ottenere la dispersione a singolo atomo di metalli preziosi e la catalisi selettiva per dimensione.
Materiali mesoporosi: Come l'SBA-15 e l'MCM-41, caratterizzati da strutture mesoporose altamente ordinate e da distribuzioni strette delle dimensioni dei pori, forniscono canali ideali per il trasferimento di massa e le reazioni di grandi molecole, risolvendo i problemi di trasferimento di massa lento dei materiali microporosi.
Carburi/Nitruri: Come il carburo di molibdeno e il nitruro di carbonio, presentano una conduttività simile a quella dei metalli, un'elevata stabilità chimica e termica. Come supporti emergenti per elettrocatalizzatori o catalizzatori sinergici, mostrano il potenziale per sostituire i supporti tradizionali.
Tabella 2: Confronto tra le caratteristiche di altri tipi di supporto
|
Tipo di supporto |
Caratteristica strutturale |
Vantaggio principale |
Applicazioni potenziali |
|
Zeoliti |
Cristallino microporoso |
Selettività di forma, forte acidità |
Idrogenazione selettiva della forma, isomerizzazione, setaccio molecolare |
|
MOF |
Cristallino poroso |
Area superficiale elevatissima, struttura progettabile |
Catalisi a singolo atomo, stoccaggio/separazione di gas |
|
Materiali mesoporosi |
Mesopori ordinati |
Dimensioni uniformi dei pori, elevata efficienza di trasferimento di massa |
Catalisi di grandi molecole, biosensing |
|
Carburi/Nitruri |
Composti interstiziali |
Alta conducibilità, alta stabilità |
Elettrocatalisi, catalisi resistente alla corrosione |
Capitolo 5: Sfide e prospettive future
I catalizzatori di metalli preziosi, pur essendo indispensabili, devono affrontare ostacoli significativi che spingono la ricerca in corso. La sfida principale rimane il loro costo elevato e la loro naturale scarsità, che crea vulnerabilità economiche e della catena di approvvigionamento per applicazioni su larga scala come la catalisi automobilistica e la produzione di prodotti chimici in massa. A ciò si aggiunge la loro tendenza intrinseca a disattivarsi, principalmente attraverso la sinterizzazione - dove le nanoparticelle si agglomerano in particelle più grandi e meno attive a temperature elevate - e attraverso l'avvelenamento da parte dei sottoprodotti di reazione. Inoltre, le prestazioni di questi catalizzatori sono spesso limitate dai materiali di supporto tradizionali che funzionano semplicemente come impalcature passive, non riuscendo a potenziare o stabilizzare attivamente il metallo prezioso. Una sfida scientifica più profonda risiede nella comprensione incompleta dei cambiamenti dinamici nei siti attivi in condizioni operative reali e delle precise relazioni struttura-attività, che ostacolano la progettazione razionale.
I progressi futuri sono strettamente legati a strategie innovative che massimizzino l'efficienza e la durata. Un punto centrale è la massimizzazione dell'efficienza di utilizzo dell'atomo. Ciò comporta il superamento della semplice dispersione di nanoparticelle per passare ad architetture avanzate come i catalizzatori a singolo atomo (Single-Atom Catalysts, SAC), che possono teoricamente raggiungere il 100% di dispersione di metalli, e sofisticate strutture core-shell o nano-frame che concentrano gli atomi preziosi sulla superficie dove avvengono le reazioni. La strategia di "estrazione dell'atomo", ad esempio, dimostra come il design delle leghe possa essere utilizzato per attirare gli atomi di metalli preziosi dal nucleo di una nanoparticella alla sua superficie, aumentando drasticamente l'efficienza e riducendo al minimo il carico.
Contemporaneamente, il ruolo del supporto viene ridefinito da spettatore passivo a partner attivo e sinergico. Il futuro risiede nella progettazione di supporti intelligenti in grado di effettuare un preciso controllo elettronico e geometrico. Ciò include l'ingegnerizzazione di forti interazioni metallo-supporto (SMSI) per ottimizzare le proprietà elettroniche e l'utilizzo di nuovi materiali come i quadri metallo-organici (MOF) o i doppi idrossidi stratificati 2D (LDH) che offrono ambienti atomicamente definiti per stabilizzare gli atomi di metallo. Il concetto di effetti di confinamento, in cui le particelle metalliche sono fisicamente intrappolate all'interno di strutture porose, è un approccio potente per prevenire la sinterizzazione.
Il paradigma di sviluppo si sta spostando dalla scoperta empirica alla progettazione razionale. L'integrazione di apprendimento automatico, calcolo ad alto rendimento e caratterizzazione avanzata in situ sta accelerando la scoperta di nuovi materiali e la comprensione dei meccanismi catalitici. Oltre all'ottimizzazione dell'uso dei metalli preziosi, la ricerca a lungo termine di catalizzatori a basso contenuto di MGP (metalli del gruppo del platino) e, in ultima analisi, privi di MGP, basati su metalli di transizione abbondanti, continua a essere un percorso critico, anche se impegnativo, verso la catalisi sostenibile. Questi sforzi combinati mirano a rompere i tradizionali compromessi tra attività, stabilità e costi.

Fig. 4 Nanotecnologie del futuro
Capitolo 6: Conclusioni
In sintesi, il supporto svolge molteplici ruoli nei catalizzatori di metalli preziosi che vanno ben oltre la semplice impalcatura fisica. È la pietra angolare per ottenere un'elevata dispersione, un'alta stabilità e un'alta efficienza di utilizzo dei metalli preziosi ed è fondamentale per migliorare attivamente le prestazioni catalitiche attraverso effetti elettronici e sinergici. Di fronte alle sfide fondamentali della scarsità e dell'instabilità dei metalli preziosi, la direzione futura è chiara: passare dal tradizionale screening empirico a una precisa progettazione razionale. Costruendo catalizzatori a singolo atomo, strutture core-shell e sviluppando nuovi supporti multifunzionali, possiamo "decorare squisitamente" i metalli preziosi su scala atomica/nanoscala. Questo ci consentirà di ridurre drasticamente l'uso di metalli preziosi e di aumentare in modo moltiplicativo le prestazioni catalitiche e la durata di vita, fornendo la forza trainante per lo sviluppo sostenibile nei settori dell'energia, dell'ambiente e della chimica.
Per soluzioni avanzate di catalizzatori di metalli preziosi che soddisfino queste esigenze in continua evoluzione, contattate Stanford Advanced Materials (SAM).
Lettura correlata:
La catalisi ridefinita: Vantaggi del palladio su carbonio
Riferimenti:
[1] Bell, A. T. (2003). L'impatto della nanoscienza sulla catalisi eterogenea. Science, 299(5613), 1688-1691.
[2] Somorjai, G. A., & Li, Y. (2010). Introduzione alla chimica delle superfici e alla catalisi. Wiley.
[3] Tauster, S. J., Fung, S. C., & Garten, R. L. (1978). Interazioni forti metallo-supporto. Metalli nobili del gruppo 8 supportati su TiO2. Journal of the American Chemical Society, *100*(1), 170-175.
[4] Cargnello, M., et al. (2013). Il controllo delle dimensioni dei nanocristalli metallici rivela il ruolo dell'interfaccia metallo-supporto per i catalizzatori di Ceria. Science, 341(6147), 771-773.

 Bar
Bar
 Perline e sfere
Perline e sfere
 Bulloni e dadi
Bulloni e dadi
 Crogioli
Crogioli
 Dischi
Dischi
 Fibre e tessuti
Fibre e tessuti
 Film
Film
 Fiocco
Fiocco
 Schiume
Schiume
 Lamina
Lamina
 Granuli
Granuli
 Nidi d'ape
Nidi d'ape
 Inchiostro
Inchiostro
 Laminato
Laminato
 Grumi
Grumi
 Maglie
Maglie
 Film metallizzato
Film metallizzato
 Piatto
Piatto
 Polveri
Polveri
 Asta
Asta
 Lenzuola
Lenzuola
 Cristalli singoli
Cristalli singoli
 Bersaglio di sputtering
Bersaglio di sputtering
 Tubi
Tubi
 Lavatrice
Lavatrice
 Fili
Fili
 Convertitori e calcolatori
Convertitori e calcolatori
 Scrivi per noi
Scrivi per noi
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


