Scala del PH: Acidi, basi e materiali comuni
Cos'è la Scala del pH?
La scala del pH misura quanto una sostanza è acida o basica (alcalina). Varia da 0 a 14. Un pH di 7 è neutro. Valori inferiori a 7 sono acidi, mentre valori superiori a 7 sono basici. L'acqua pura ha un pH neutro di 7.
Quando le sostanze si dissolvono in acqua, possono alterare il pH. Ad esempio, l'aceto e il succo di limone sono acidi, mentre sostanze come l'ammoniaca e il detersivo per bucato sono basiche. Proprio come caldo e freddo descrivono la temperatura, acido e basico descrivono proprietà chimiche.
Come si Misura il pH?
Il pH si misura utilizzando un pHmetro o cartine al tornasole. Il pHmetro utilizza un elettrodo di vetro per rilevare la concentrazione di ioni idrogeno in una soluzione. Le cartine al tornasole contengono indicatori che cambiano colore in base all'acidità o all'alcalinità della sostanza con cui entrano in contatto.
Scala del pH di Acidi e Basi Comuni
Tutti i valori di pH sono misurati in soluzioni acquose alla concentrazione di 10 mM.
Acidi Forti
Dissociazione completa in acqua (pKa < –1)
|
Nome dell'Acido |
Formula |
pH Appross. (10 mM) |
|
Acido cloridrico |
HCl |
2.04 |
|
Acido nitrico |
HNO₃ |
2.04 |
|
Acido bromidrico |
HBr |
2.04 |
|
Acido iodidrico |
HI |
2.04 |
|
Acido solforico¹ |
H₂SO₄ |
1.87 |
|
Acido perclorico² |
HClO₄ |
~1.6 |
|
Acido selenico |
H₂SeO₄ |
1.83 |
Acidi Deboli
Dissociazione parziale in acqua (pKa > 3)
|
Nome dell'Acido |
Formula |
pH Appross. (10 mM) |
|
Acido ortofosforico |
H₃PO₄ |
2.26 |
|
Acido arsenico |
H₃AsO₄ |
2.31 |
|
Acido selenioso |
H₂SeO₃ |
2.47 |
|
Acido fluoridrico |
HF |
2.65 |
|
Acido nitroso |
HNO₂ |
2.67 |
|
Acido molibdico |
H₂MoO₄ |
2.94 |
|
Solfuro di idrogeno |
H₂Se |
2.93 |
|
Acido carbonico |
H₂CO₃ |
4.18 |
|
Solfuro di idrogeno |
H₂S |
4.47 |
|
Acido arsenioso |
H₃AsO₃ |
5.58 |
|
Acido borico |
H₃BO₃ |
5.62 |
|
Acido silicico |
H₄SiO₄ |
5.91 |
Basi Forti
Dissociazione completa in acqua (elevata solubilità, Kb grande)
|
Nome della Base |
Formula |
pH Appross. (10 mM) |
|
Idrossido di sodio |
NaOH |
11.95 |
|
Idrossido di potassio |
KOH |
11.95 |
|
Idrossido di bario |
Ba(OH)₂ |
12.22 |
|
Idrossido di calcio |
Ca(OH)₂ |
12.20 |
Basi Deboli
Dissociazione parziale o bassa solubilità (Kb piccolo o insolubile)
|
Nome della Base |
Formula |
pH Appross. (10 mM) |
Note |
|
Idrossido di ammonio |
NH₄OH |
10.61 |
In realtà NH₃•H₂O |
|
Idrossido di magnesio* |
Mg(OH)₂ |
10.40 |
Soluzione satura |
|
Idrossido di ferro(II)* |
Fe(OH)₂ |
9.45 |
Soluzione satura |
|
Carbonato di sodio |
Na₂CO₃ |
10.97 |
Sale basico |
|
Fosfato trisodico |
Na₃PO₄ |
~12.10 |
Sale fortemente basico |
|
Metasilicato di sodio |
Na₂SiO₃ |
11.91 |
Silicato alcalino |
|
Idrossido di zinco* |
Zn(OH)₂ |
8.88 |
Scarsamente solubile |
|
Idrossido di nichel(II)* |
Ni(OH)₂ |
8.37 |
Scarsamente solubile |
|
Idrossido di cobalto(II)* |
Co(OH)₂ |
9.15 |
Scarsamente solubile |
|
Idrossido di cromo(III)* |
Cr(OH)₃ |
7.04 |
Scarsamente solubile |
|
Idrossido di berillio* |
Be(OH)₂ |
7.90 |
Anfotero |
|
Idrossido di rame(II)* |
Cu(OH)₂ |
7.69 |
Scarsamente solubile |
|
Borato di sodio (borace) |
Na₂B₄O₇ |
9.17 |
Base debole per idrolisi |
|
Bicarbonato di sodio |
NaHCO₃ |
8.22 |
Sale debolmente basico |
|
Bicarbonato di potassio |
KHCO₃ |
8.25 |
Sale debolmente basico |
*Limitato dalla solubilità — i valori di pH si riferiscono a soluzioni sature, non alla concentrazione completa di 10 mM.
Note per i Lettori o Utenti
- Forte vs. debole è definito dall'estensione della dissociazione, non solo dal pH.
- I valori di pH variano con la temperatura e la forza ionica.
- Questa tabella presuppone una temperatura di 25°C, una soluzione acquosa diluita e una concentrazione nominale di 10 mM, salvo diversa indicazione.
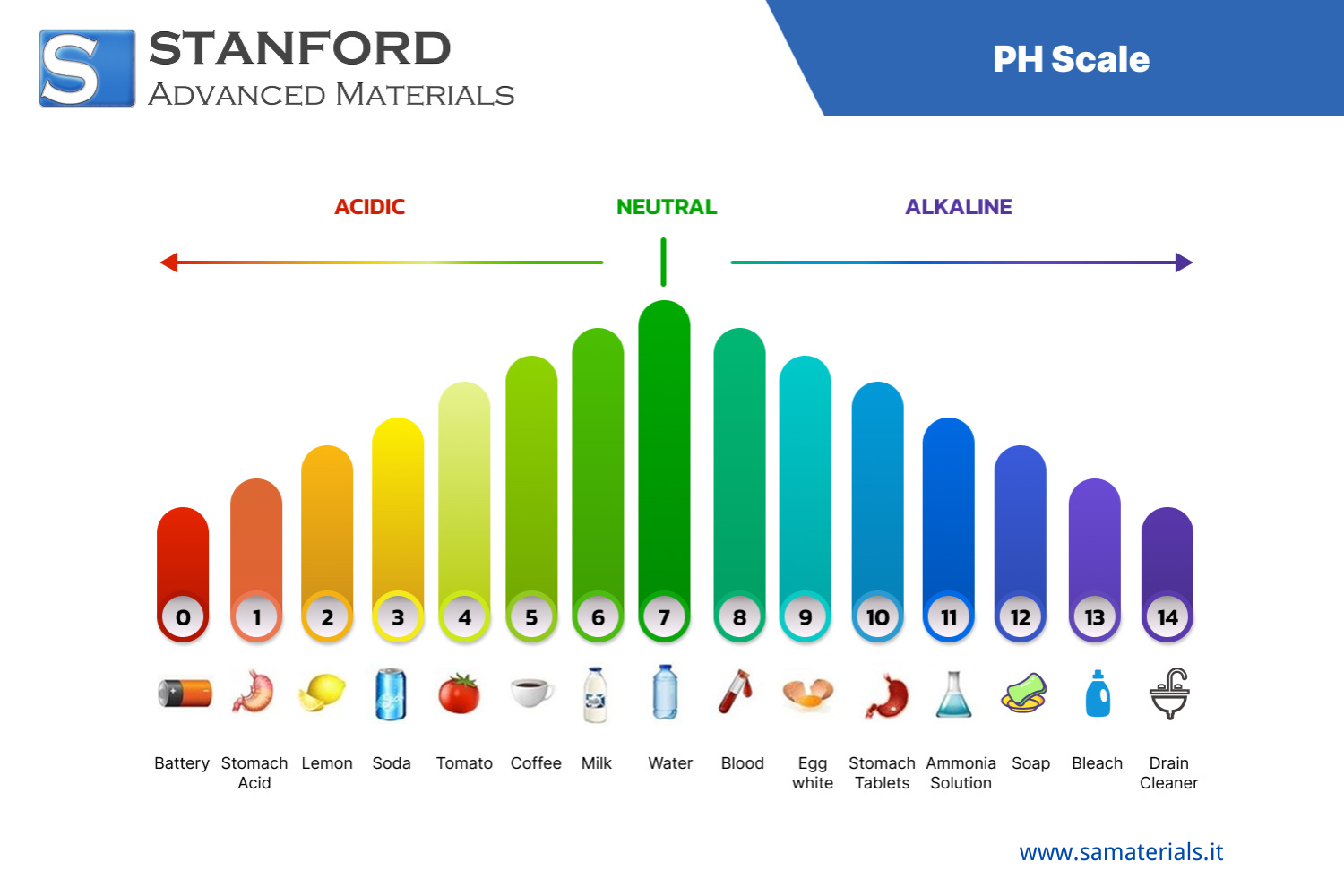
Scala del pH di Materiali Comuni
pH 0 – Estremamente acido
- Acido di batteria (acido solforico) – altamente corrosivo, uso industrial
pH 1 – Acido molto forte
- Acido gastrico (acido cloridrico) – essenziale per la digestion
- Soluzioni acide industriali
pH 2
- Succo di limone – acido naturale della frutta
- Aceto (acido acetico) – usato in cucina e pulizia
- Cola e bevande sportive – acidi per l'acido fosforico
pH 3
- Succo d'arancia – acido di agrumi
- Bibite gassate
- Alimenti sott'aceto
pH 4
- Pomodori e succo di pomodoro
- Pioggia acida – problema ambientale, spesso intorno a pH 4.0–4.5
- Mele e uva
pH 5
- Caffè nero – leggermente acido per acidi organici
- Banane
- Pane
pH 6
- Urina – varia in base a idratazione e dieta
- Latte – quasi neutro ma leggermente acido
- Saliva (a riposo)
pH 7 – Neutro
- Acqua distillata – riferimento per la neutralità
- Sangue umano (tecnicamente ~7.4 ma considerato quasi neutro per riferimento)
pH 8
- Acqua di mare – leggermente basica per minerali disciolti
- Uova (soprattutto albume)
- Lievito in polvere (leggermente basico se disciolto)
pH 9
- Bicarbonato di sodio – comune antiacido
- Dentifricio (alcuni tipi)
- Sapone per mani (base lieve)
pH 10
- Latte di magnesia (idrossido di magnesio) – usato per indigestion
- Acqua del Gran Lago Salato – ambiente ricco di minerali, alcalino
- Alcuni detergenti
pH 11
- Soluzione di ammoniaca (detergente domestico)
- Pulitori per vetri
- Prodotti a base di candeggina leggera
pH 12
- Acqua saponosa – alcalina per i sali di sodio
- Detersivi pesante
- Rilassanti per capelli
pH 13
- Pulitori per forno – contengono basi forti come l'idrossido di sodio
- Candeggina domestica (concentrata)
pH 14 – Estremamente basico (alcalino)
- Liquido per sturare scarichi – altamente caustico, spesso idrossido di sodio o potassio puro
- Sgrassatori industriali
Altre Domande Relative alla Scala del pH
1. Cosa sono acidi e basi? Esempi?
Gli acidi sono sostanze che rilasciano ioni idrogeno (H⁺) quando disciolti in acqua, aumentandone la concentrazione. Le basi, invece, rilasciano ioni idrossido (OH⁻) o accettano ioni idrogeno, riducendone la concentrazione.
Esempi comuni di acidi includono l'acido cloridrico (presente nello stomaco), l'acido citrico (negli agrumi) e l'aceto (acido acetico). Le basi includono sostanze come l'idrossido di sodio (soda caustica), il bicarbonato di sodio e l'ammoniaca.
2. Perché il pH è importante? Qual è il suo impatto nella vita quotidiana?
Il pH è cruciale in chimica, biologia e scienze ambientali. Nel corpo umano, diversi livelli di pH sono vitali per gli enzimi e l'omeostasi. In agricoltura, il pH influenza la qualità del suolo e la crescita delle piante. Nell'industria, come nel trattamento delle acque, la regolazione del pH è essenziale per sicurezza ed efficienza.
Il pH influenza il gusto di cibi e bevande (es. cibi acidi come i limoni sono aspri, mentre le basi possono essere amare o saponose). Inoltre, incide sull'efficacia dei detergenti e sulla salute degli ecosistemi acquatici.
3. I livelli di pH possono cambiare?
Sì, i livelli di pH possono variare per fattori come l'aggiunta di acidi/basi, reazioni chimiche, processi biologici e condizioni ambientali, alterando il pH di acqua, suolo o persino del corpo umano.
Riferimento:
[1] NOAA Pacific Marine Environmental Laboratory CO2 Program (2021). The pH scale with some common examples [Fotografia]. https://www.pmel.noaa.gov/co2/file/The+pH+scale+with+some+common+examples

 Bar
Bar
 Perline e sfere
Perline e sfere
 Bulloni e dadi
Bulloni e dadi
 Crogioli
Crogioli
 Dischi
Dischi
 Fibre e tessuti
Fibre e tessuti
 Film
Film
 Fiocco
Fiocco
 Schiume
Schiume
 Lamina
Lamina
 Granuli
Granuli
 Nidi d'ape
Nidi d'ape
 Inchiostro
Inchiostro
 Laminato
Laminato
 Grumi
Grumi
 Maglie
Maglie
 Film metallizzato
Film metallizzato
 Piatto
Piatto
 Polveri
Polveri
 Asta
Asta
 Lenzuola
Lenzuola
 Cristalli singoli
Cristalli singoli
 Bersaglio di sputtering
Bersaglio di sputtering
 Tubi
Tubi
 Lavatrice
Lavatrice
 Fili
Fili
 Convertitori e calcolatori
Convertitori e calcolatori
 Chin Trento
Chin Trento



