Catalizzatori di metalli preziosi Pt, Pd e Au migliori: Risolvere i colli di bottiglia delle prestazioni
Astratto
I catalizzatori di metalli preziosi sono fondamentali per migliorare l'efficienza dei processi energetici e chimici grazie alla loro straordinaria attività intrinseca. Tuttavia, il loro impiego pratico è limitato da problemi persistenti legati all'attività, alla selettività, alla stabilità e al costo. Questa rassegna affronta sistematicamente i limiti fondamentali delle prestazioni di tre importanti catalizzatori a base di metalli preziosi - Pt, Pd e Au - ed esamina le strategie di progettazione di materiali avanzati ideate per superare questi problemi. In particolare, ci concentriamo su:
1) Architetture di lega e core-shell nei catalizzatori a base di Pt per migliorare l'attività di riduzione dell'ossigeno e la durata nelle celle a combustibile;
2) configurazioni a singolo atomo e a nanocluster nei sistemi a base di Pd per ottenere una selettività superiore e resistenza alla sinterizzazione nelle reazioni di cross-coupling; e
3) progettazione del supporto e controllo delle dimensioni nei catalizzatori di Au per ottenere un'elevata attività nell'ossidazione del CO a bassa temperatura.
Confrontando le soluzioni personalizzate per questi tre sistemi catalitici, questo lavoro mira a fornire approfondimenti interdisciplinari e a guidare la progettazione razionale di catalizzatori di metalli preziosi di prossima generazione ad alte prestazioni, durevoli ed economici.

Fig. 1 Catalizzatori di nano-metalli preziosi
1 Introduzione
I catalizzatori di metalli preziosi (come il platino, il palladio, il rodio, ecc.) servono come materiali critici nelle moderne transizioni industriali ed energetiche, svolgendo un ruolo centrale nei settori della raffinazione, della sintesi chimica, del controllo delle emissioni automobilistiche e dell'energia da idrogeno. In particolare, nel contesto di un cambiamento globale verso strutture energetiche più pulite, il rapido sviluppo delle celle a combustibile e delle industrie dell'idrogeno a basse emissioni di carbonio continua a far crescere la domanda di metalli del gruppo del platino. Le proiezioni del settore indicano che entro il 2030 la capacità di produzione globale di idrogeno pulito dovrebbe superare i dieci milioni di tonnellate, consolidando ulteriormente l'importanza strategica dei catalizzatori di metalli preziosi nella catena di approvvigionamento energetico.
Tuttavia, l'adozione diffusa dei catalizzatori di metalli preziosi deve ancora affrontare diverse sfide strutturali. La produzione annuale globale di metalli del gruppo del platino è limitata e geograficamente concentrata, rendendo le catene di approvvigionamento altamente vulnerabili alle tensioni geopolitiche e alla volatilità del mercato. Per ridurre la dipendenza da risorse esterne, migliorare l'efficienza del riciclo dei materiali critici è diventata una strategia prioritaria per molte nazioni. Attualmente, il recupero dei metalli preziosi dai catalizzatori industriali esausti si basa principalmente su processi quali la pirolisi, l'estrazione idrometallurgica e la fusione pirometallurgica. Tuttavia, questi metodi sono generalmente caratterizzati da un elevato consumo energetico e da tassi di recupero compromessi dalle impurità. Nell'ambito dell'innovazione tecnologica, i ricercatori stanno sviluppando alternative di metalli non preziosi e sistemi di solventi verdi per ridurre la dipendenza da minerali vergini. Contemporaneamente, normative ambientali sempre più severe spingono a creare sistemi di gestione che coprano l'intero ciclo di vita dei catalizzatori, dalla produzione all'uso fino alla rigenerazione, spingendo l'industria a bilanciare l'efficienza delle risorse con la responsabilità ambientale.
La progettazione strutturale di precisione è emersa come un paradigma chiave per superare le strozzature delle prestazioni nei catalizzatori di metalli preziosi. Questa strategia mira a ottenere un controllo sinergico sulle strutture elettroniche e geometriche dei siti attivi su scala atomica. In particolare, le tecniche di modulazione della struttura elettronica, come l'ingegneria delle leghe e delle deformazioni, ottimizzano il comportamento di adsorbimento degli intermedi di reazione, migliorando così l'attività intrinseca. L'ingegneria geometrica, come la costruzione di singoli atomi, nanocluster, piani cristallini specifici o strutture core-shell, massimizza la densità e la stabilità del sito attivo. Nel frattempo, l'ingegneria dell'interfaccia del vettore e gli effetti di confinamento spaziale consentono di guidare con precisione il percorso di reazione, superando così le sfide del controllo selettivo e della stabilità a lungo termine. Questo articolo esplora sistematicamente le strategie di progettazione strutturale di tre catalizzatori rappresentativi - Pt, Pd e Au - basate su questo concetto.

Fig. 2 Catalizzatori di metalli preziosi per la combustione dei gas
2 Problemi comuni e meccanismi di declino delle prestazioni dei catalizzatori di metalli preziosi
2.1 Carenza di sito attivo e basso tasso di utilizzazione
2.1.1 Assorbimento di veleni e blocco dei siti attivi
Le impurità presenti nell'alimentazione della reazione, come le specie contenenti zolfo (ad esempio, H₂S, composti organici dello zolfo) e cloro (ad esempio, ioni cloruro, organoclorurati), possono adsorbire fortemente sui centri attivi delle nanoparticelle di metalli nobili. Questo processo di chemisorbimento porta spesso alla formazione di composti superficiali stabili come il solfuro di rodio (Rh₂S₃) o il cloruro di rodio (RhCl₃), che occupano e disattivano permanentemente i siti catalitici. Inoltre, la deposizione di queste impurità sul supporto del catalizzatore può bloccare fisicamente i mesopori e i micropori dei materiali di carbonio, ostacolando così la diffusione delle molecole reagenti ai siti attivi.
2.1.2 Agglomerazione delle particelle metalliche e degradazione del supporto
Le nanoparticelle di metalli nobili (tipicamente di dimensioni comprese tra 2 e 10 nm) sono suscettibili di migrazione e coalescenza durante i cicli di reazione ad alta temperatura, portando alla formazione di grandi agglomerati di dimensioni superiori a 50 nm. Questo fenomeno di sinterizzazione può ridurre la superficie elettrochimicamente attiva di oltre il 75%. Contemporaneamente, il supporto di carbonio stesso subisce una degradazione in caso di esposizione prolungata ad alte temperature, che si manifesta con decomposizione termica, formazione di crepe e perdita di resistenza meccanica. Questo collasso strutturale del supporto accelera ulteriormente l'agglomerazione delle particelle metalliche e compromette l'integrità complessiva dell'architettura del catalizzatore.
2.1.3 Dissoluzione e distacco indotti da fluttuazioni del processo
Le instabilità operative, in particolare quando il potenziale redox del sistema di reazione fluttua oltre la finestra di tolleranza del catalizzatore (in genere ±0,3 V), possono indurre la dissoluzione anodica del metallo nobile in ambienti acidi. Questo processo genera specie ioniche solubili, come il Rh³⁺, con conseguente perdita irreversibile del metallo. Parallelamente, l'esposizione prolungata a condizioni altamente acide o alcaline può provocare l'idrolisi o la neutralizzazione dei gruppi funzionali sulla superficie del supporto di carbonio, indebolendo l'interazione metallo-supporto e provocando il distacco delle particelle attive.
2.1.4 Corrosione mediata dal vapore e collasso dei pori
Nei sistemi contenenti vapore acqueo, la condensazione e la permeazione del vapore all'interno dei nanopori del supporto di carbonio generano forze capillari e tensioni interfacciali. Queste tensioni possono causare microfratture e il collasso della struttura dei pori. Contemporaneamente, il vapore acqueo può interagire con le impurità (ad esempio, Cl-, SO₄²-) per formare un elettrolita corrosivo localizzato, che accelera la dissoluzione delle nanoparticelle metalliche e il loro successivo distacco dal supporto compromesso.
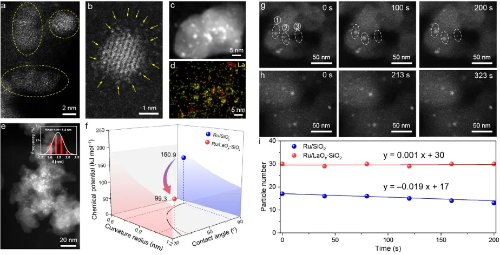
Fig. 3 Catalizzatori a isola nanostrutturati per contrastare la sinterizzazione delle particelle
2.2 Sinterizzazione e maturazione di Ostwald delle nanoparticelle
La sinterizzazione delle nanoparticelle metalliche supportate rappresenta una causa fondamentale di disattivazione ad alta temperatura nei catalizzatori eterogenei. Secondo le conoscenze tradizionali, la sinterizzazione avviene principalmente attraverso due meccanismi mediati dal substrato: la maturazione di Ostwald e la migrazione e coalescenza delle particelle. Mentre tecniche avanzate in situ, come la microscopia elettronica a trasmissione ambientale, hanno convalidato questi percorsi in condizioni di pressione quasi ambiente, i meccanismi di evoluzione dinamica delle nanoparticelle nelle condizioni industriali estreme di alta temperatura e alta pressione rimangono insufficientemente compresi.
Recenti ricerche, che hanno impiegato simulazioni Monte Carlo cinetiche reattive combinate con calcoli di teoria funzionale della densità, hanno rivelato un meccanismo di salto e coalescenza delle particelle (PHC) precedentemente non riconosciuto in condizioni di alta pressione di CO e temperatura elevata. Questo processo prevede che le nanoparticelle di Au si stacchino dal supporto di TiO₂(101) anatasio, subiscano un "salto aereo" tramite migrazione in fase gassosa e si coalizzino con altre particelle. Una volta che i cluster coalizzati superano una dimensione critica, si depositano nuovamente sulla superficie del supporto. Questo comportamento è guidato dalla forte interazione tra le molecole di CO e gli atomi di Au interfacciali in presenza di un elevato potenziale chimico del CO, che supera l'energia di legame nanoparticella-supporto.
Questo meccanismo non solo chiarisce i percorsi di disattivazione rapida dei catalizzatori in condizioni di lavoro realistiche, ma implica anche che la sinterizzazione delle nanoparticelle e la migrazione tra i supporti possono verificarsi molto più frequentemente e dinamicamente di quanto precedentemente ipotizzato. I risultati forniscono una nuova prospettiva teorica per la comprensione della perdita di stabilità termica nei catalizzatori industriali e stabiliscono un quadro metodologico per la simulazione di sistemi su scala nanometrica su scale spaziali e temporali accoppiate.

Fig. 4 Maturazione di Ostwald
2.3 Avvelenamento dei catalizzatori di metalli preziosi
L'avvelenamento dei catalizzatori di metalli preziosi si riferisce al fenomeno per cui tracce di impurità nel sistema di reazione occupano o degradano irreversibilmente i siti attivi attraverso il chemiosorbimento o le reazioni chimiche, portando a un declino significativo dell'attività e della selettività del catalizzatore. Rappresenta una delle principali cause di disattivazione dei catalizzatori industriali.
2.3.1 Meccanismi e tipi di avvelenamento
In base alla natura dell'interazione tra il veleno e i siti attivi, l'avvelenamento viene tipicamente classificato in due tipi:
A) Avvelenamento chimico: Il veleno interagisce fortemente con i siti attivi attraverso forze chimiche. Questa è la forma più comune di avvelenamento.
- Avvelenamento per forte chemisorbimento: Le molecole velenose subiscono un chemisorbimento irreversibile o fortemente reversibile sui siti attivi, con energie di adsorbimento molto più elevate di quelle dei reagenti bersaglio, bloccando così fisicamente i siti. Ad esempio, i composti contenenti zolfo, fosforo e cianuro presentano capacità di adsorbimento molto forti su molte superfici metalliche.
- Avvelenamento tramite effetti elettronici: Il veleno altera la struttura elettronica (ad esempio, il centro della banda d) dei centri attivi del metallo prezioso donando o sottraendo elettroni, modificando di conseguenza la capacità di adsorbimento dei reagenti e impedendo la reazione catalitica.
- Avvelenamento tramite effetti strutturali: Alcuni veleni possono indurre il riarrangiamento degli atomi di superficie, alterando la struttura geometrica originale dei centri attivi.
B) Avvelenamento fisico/incrostazione: Il veleno stesso può non interagire chimicamente con i siti attivi, ma si deposita fisicamente sui siti attivi o sulle bocche dei pori del supporto, ostacolando il trasferimento di massa dei reagenti.
2.3.2 Veleni comuni e loro meccanismi
I diversi metalli preziosi presentano sensibilità diverse ai vari veleni. La tabella seguente elenca i veleni tipici e i loro effetti:
Tabella 1 Veleni tipici
|
Categoria di veleno |
Sostanze rappresentative |
Catalizzatori principalmente colpiti |
Breve descrizione del meccanismo |
|
Composti contenenti zolfo |
H₂S, COS, SO₂, Mercaptani, Tiofene |
Pt, Pd, Rh, Ru |
Gli atomi di S possiedono una coppia di elettroni solitari che consentono una coordinazione molto efficace agli orbitali d dei metalli preziosi, formando legami M-S stabili. Sono tra i veleni più comuni e potenti. |
|
Composti contenenti alogeni |
Cl-, HCl, cloruri organici |
Pt, Pd |
Gli ioni o gli atomi alogeni sono altamente elettronegativi e si adsorbono fortemente sulle superfici metalliche, alterando le prestazioni catalitiche attraverso effetti elettronici. A volte possono causare la perdita del metallo formando alogenuri volatili. |
|
Composti di metalli pesanti |
Composti di Pb, Hg, As, Bi, Sn |
La maggior parte dei catalizzatori di metalli preziosi |
Questi metalli o i loro ioni hanno un basso potenziale di deposizione sulle superfici dei metalli preziosi e possono coprire in modo permanente i siti attivi attraverso reazioni irreversibili di spostamento del metallo o di lega. |
|
Composti contenenti fosforo/azoto |
PH₃, Fosfine, Ammine, Cianuri |
Ni, Pd, Pt |
Come i composti contenenti S, gli atomi di P e N hanno una forte capacità di coordinazione e possono formare legami di coordinazione stabili con i centri attivi. |
|
Idrocarburi insaturi / Coke |
Alcheni, alchini, precursori del coke |
La maggior parte dei catalizzatori metallici |
Subiscono reazioni di polimerizzazione e deidrogenazione ad alte temperature, formando depositi carboniosi ad alto peso molecolare che coprono fisicamente i siti attivi e i pori. |
2.3.3 Fattori che influenzano il grado di avvelenamento
Natura del veleno: La forza di adsorbimento, l'ostacolo sterico e gli effetti elettronici della molecola velenosa sul sito attivo.
Proprietà del catalizzatore: La struttura elettronica dei diversi metalli preziosi determina la loro resistenza all'avvelenamento; ad esempio, il Pt è sensibile al CO, mentre il Pd è sensibile allo S. Anche le proprietà del supporto influenzano la diffusione e l'adsorbimento dei veleni.
Condizioni di processo: Temperatura, pressione, concentrazione del reagente, ecc. Ad esempio, l'alta temperatura può desorbire alcuni veleni ma può anche accelerare il coking; un'atmosfera riducente può inibire l'adsorbimento di alcuni veleni ossidanti (ad esempio, SO₂).
2.4 Dissoluzione e lisciviazione dei metalli
La dissoluzione e la lisciviazione dei metalli rappresentano una via di degradazione critica nell'elettrocatalisi, in particolare per i catalizzatori a base di platino e palladio in condizioni operative. Il meccanismo di dissoluzione elettrochimica comporta complessi processi dipendenti dal potenziale in cui gli atomi di metallo nobile si ossidano in specie ioniche solubili. Ad esempio, il platino subisce un'ossidazione sequenziale per formare ioni Pt²⁺ e Pt⁴⁺ che migrano nell'elettrolita, seguendo un percorso dinamico di dissoluzione-rideposizione in cui le specie disciolte si ridepositano preferenzialmente su particelle più grandi o su regioni più catodiche. Questo fenomeno è significativamente accelerato in condizioni di ciclaggio del potenziale, con tassi di dissoluzione fortemente influenzati da parametri operativi quali finestre di potenziale, temperatura, pH e velocità di scansione.
I difetti strutturali fungono da siti primari di innesco per la dissoluzione, dove gli angoli, i bordi e i siti di dislocazione mostrano una maggiore suscettibilità all'attacco ossidativo. Studi avanzati in situ rivelano che le nanostrutture core-shell, come i nanocubi Pd@Pt, subiscono una degradazione esacerbata attraverso la corrosione galvanica e i meccanismi di corrosione indotti dagli alogenuri, a partire dall'interfaccia core-shell e propagandosi verso l'esterno. Contemporaneamente, la corrosione del materiale di supporto, in particolare la degradazione del supporto di carbonio a potenziali e temperature elevate, aggrava ulteriormente la perdita di metallo indebolendo l'ancoraggio delle particelle.
Le strategie di mitigazione si concentrano sul miglioramento della stabilità termodinamica degli atomi di metallo attraverso la modulazione della struttura elettronica. La lega del platino con elementi più nobili come l'oro ha dimostrato una notevole efficacia: l'incorporazione dell'Au eleva il potenziale di insorgenza della dissoluzione e riduce i tassi di dissoluzione di circa il 40% grazie alla donazione di elettroni che aumenta la nobiltà del platino. Le architetture core-shell che utilizzano materiali più economici (ad esempio, il Pd) riducono contemporaneamente l'uso di metalli preziosi e introducono una tensione di compressione per migliorare la stabilità del guscio. In alternativa, la dispersione su scala atomica attraverso catalizzatori a singolo atomo ancorati su supporti modificati (ad esempio, Pt su CeO₂ drogato con Zr) raggiunge una stabilità eccezionale, mantenendo l'integrità strutturale anche in condizioni idrotermali difficili a 800°C, impedendo la migrazione delle particelle e la sinterizzazione.
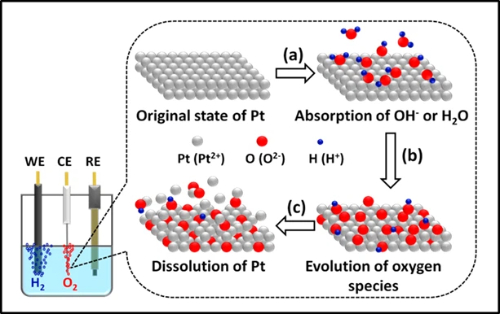
Fig. 5 Fenomeno di dissoluzione del platino nel processo elettrochimico di scissione dell'acqua per la produzione di idrogeno
2.5 Perdita del controllo della selettività
Il controllo preciso dei percorsi di reazione rappresenta una sfida fondamentale nelle reazioni complesse a più fasi, in cui i catalizzatori a base di palladio mostrano spesso una selettività compromessa a causa di un'energia di adsorbimento degli intermedi non ottimizzata. Il meccanismo alla base della selettività risiede nella struttura elettronica dei siti attivi, in particolare nella posizione del centro della banda d, che determina le forze di adsorbimento dei reagenti e degli intermedi. Nella riduzione elettrochimica del nitrile ad ammine primarie, i catalizzatori convenzionali a base di Pd dimostrano un'eccessiva forza di adsorbimento verso gli intermedi *CH₃CN, promuovendo percorsi di riduzione profonda indesiderati e reazioni collaterali di evoluzione dell'idrogeno che collettivamente diminuiscono l'efficienza faradaica verso i prodotti target.
Le strategie avanzate di progettazione dei catalizzatori affrontano con successo queste limitazioni attraverso una precisa manipolazione delle strutture elettroniche e geometriche della superficie. L'ingegneria della deformazione del reticolo esemplifica questo approccio, dove gli aeros metallenici Pd@Pd-Cu raggiungono una notevole selettività dell'etilammina del 95,38% introducendo una deformazione compressiva controllata che sintonizza in modo ottimale la posizione centrale della banda d e la forza di adsorbimento intermedio. L'incorporazione del rame genera superfici di palladio precisamente tese che bilanciano l'attivazione di *CH₃CN e la stabilizzazione dell'intermedio *CH₃CH=NH, sopprimendo efficacemente i percorsi concorrenti.
Un'ulteriore innovazione emerge dai principi di progettazione ad alta entropia, dove il metallene ad alta entropia PdRhFeCoMo sconvolge la simmetria convenzionale del sito attraverso il disordine configurazionale. Questo "effetto cocktail" crea ambienti di coordinazione locali unici che migliorano significativamente l'adsorbimento dell'etanolo e la capacità di scissione del legame C-C, raggiungendo una selettività senza precedenti del percorso C1 dell'84,12% nell'ossidazione dell'etanolo e migliorando contemporaneamente la resistenza all'avvelenamento grazie al comportamento modificato dell'idrogeno superficiale.
La sinergia bimetallica fornisce ulteriori dimensioni per l'ottimizzazione della selettività, come dimostrato dagli aeros di metallene Pt-Pd in cui l'incorporazione del platino modula il centro della banda d del palladio per creare catalizzatori a doppia funzione in grado di promuovere contemporaneamente l'ossidazione anodica dell'etanolo e l'evoluzione catodica dell'idrogeno. Questa ottimizzazione della struttura elettronica bilancia l'energia di adsorbimento per diversi intermedi attraverso molteplici reazioni, consentendo processi efficienti a cascata.
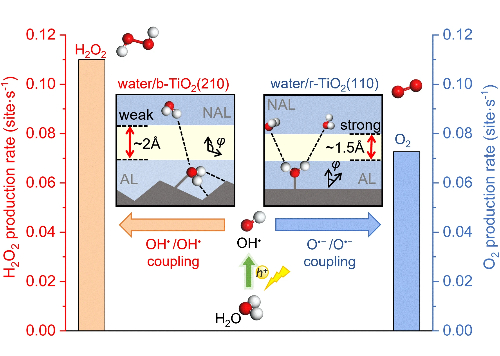
Fig. 6 Controllo selettivo dell'ossidazione fotocatalitica dell'acqua
3 Tre soluzioni specifiche per i materiali
3.1 Approccio alle soluzioni catalitiche a base di platino
I catalizzatori a base di platino (Pt) sono essenziali per la reazione di riduzione dell'ossigeno (ORR) al catodo delle celle a combustibile a membrana a scambio protonico (PEMFC), ma la loro commercializzazione su larga scala rimane ostacolata da tre sfide fondamentali: una cinetica ORR lenta, un costo elevato dovuto alla scarsità di Pt e la degradazione strutturale - tra cui la dissoluzione, la migrazione e la sinterizzazione delle nanoparticelle di Pt - in condizioni operative dinamiche come i cicli di potenziale e l'alta tensione. Per affrontare queste limitazioni, sono state sviluppate strategie di progettazione di materiali avanzati, principalmente incentrate sui tre approcci seguenti.

Fig. 7 Miglioramento della stabilità dei catalizzatori a base di platino per celle a combustibile
Soluzione 1: leghe Pt-M e strutture Core-Shell
Questo approccio prevede l'adattamento della struttura elettronica del Pt attraverso l'introduzione di metalli di transizione (M), che migliorano sia l'attività catalitica che la durata, riducendo al contempo il carico di Pt.
Descrizione della strategia:
Le nanoparticelle di lega a base di Pt - che incorporano metalli di transizione come Ni, Co, Fe o Cu - sono sintetizzate con metodi chimici umidi o di sostituzione galvanica. In alternativa, vengono costruite architetture core-shell (ad esempio, Pd@Pt) o strutture Pt-skin, in cui un guscio ricco di Pt racchiude un materiale centrale più economico come il Pd o un metallo non nobile.
Meccanismo d'azione:
Effetto elettronico (ligando): Il trasferimento di elettroni dai metalli di transizione al Pt sposta il centro della banda d del Pt, ottimizzando l'energia di adsorbimento degli intermedi contenenti ossigeno (ad esempio, O e OH) e accelerando così la cinetica ORR. Ad esempio, la superficie Pt3Ni(111) mostra un'attività ORR dieci volte superiore a quella del Pt(111).
Effetto geometrico (deformazione): Il disadattamento del reticolo tra il nucleo e il guscio di Pt induce una deformazione da compressione, che mette ulteriormente a punto la struttura elettronica del Pt e ne migliora le prestazioni catalitiche.
Vantaggi economici:
Concentrando il Pt nello strato superficiale, le strutture a guscio massimizzano l'efficienza di utilizzo del Pt, riducendo significativamente il costo complessivo del catalizzatore.
Soluzione 2: controllo della morfologia ed esposizione di sfaccettature ad alto indice
Questa strategia si concentra sulla modellazione dei nanocristalli di Pt per esporre sfaccettature cristalline altamente attive, migliorando l'attività di massa senza alterare la composizione chimica.
Descrizione della strategia:
Utilizzando tecniche di sintesi colloidale con tensioattivi e cinetiche di riduzione accuratamente controllate, vengono prodotte nanostrutture di Pt ben definite, come nanocubi (sfaccettature {100}), ottaedri (sfaccettature {111}) e strutture dendritiche.
Meccanismo d'azione:
Sfaccettature ad alta attività: le sfaccettature ad alto indice (ad esempio, {730}, {510}) possiedono un'alta densità di atomi a gradino e di kink, che fungono da siti attivi altamente insaturi. Questi siti facilitano la scissione del legame O-O e il desorbimento degli intermedi, portando a un'attività ORR intrinseca superiore.
Integrità strutturale: Alcune architetture, come le nanoframme e le nanostrutture ramificate, forniscono strutture robuste che resistono alla migrazione e alla coalescenza delle particelle, migliorando così la stabilità catalitica.
Soluzione 3: Supporti stabili e forte interazione metallo-supporto
Questo approccio mira a mitigare la corrosione del supporto di carbonio, causa principale del distacco e della degradazione delle nanoparticelle di Pt, impiegando materiali portanti robusti e funzionalizzati.
Descrizione della strategia:
I supporti convenzionali in carbonio vengono sostituiti con materiali avanzati, tra cui:
Carboni grafitici (ad esempio, grafene, nanotubi di carbonio), noti per l'elevata conducibilità elettrica e la resistenza alla corrosione;
carboni drogati con eteroatomi (ad esempio, drogati con N, B, P), che migliorano l'interazione metallo-supporto e modificano le proprietà elettroniche;
ossidi/carburi metallici (ad esempio, TiO2, SnO2, TiC), che offrono un'eccellente stabilità in condizioni di ossidazione.
Meccanismo d'azione:
Forte interazione metallo-supporto (SMSI): Gruppi funzionali o difetti sulla superficie del supporto formano forti legami covalenti (ad esempio, Pt-O-Ti) con le nanoparticelle di Pt, sopprimendo efficacemente la migrazione delle particelle, la maturazione di Ostwald e il distacco.
Maggiore durata: La superiore stabilità elettrochimica di questi supporti in condizioni di alto potenziale riduce al minimo la perdita di Pt indotta dalla corrosione, prolungando così la durata del catalizzatore.
Tabella 1 Soluzioni catalitiche a base di platino Tabella comparativa
|
Soluzioni |
Strategie principali |
Meccanismi per migliorare l'attività |
Meccanismi per migliorare la stabilità |
Costo-efficacia |
Sfide chiave |
|
Leghe Pt-M e strutture Core-Shell |
Regolazione della composizione e della struttura |
Gli effetti dei ligandi e delle deformazioni ottimizzano congiuntamente i centri della banda d del Pt, abbassando la barriera energetica dell'ORR. |
Gli elementi di lega o gli strati del nucleo aumentano il potenziale di dissoluzione del Pt attraverso effetti di supporto; alcuni elementi di lega (ad esempio, il Ni) formano strutture Pt-skin al momento della dissoluzione, migliorando la stabilità della superficie. |
Alto (riduce significativamente il consumo di Pt) |
I metalli di transizione possono lisciviare in ambienti acidi, con conseguente decadimento dell'attività e incrostazioni della membrana; i processi di fabbricazione delle strutture core-shell sono complessi. |
|
Controllo della morfologia e piani cristallini ad alto indice |
Ingegneria della superficie |
L'esposizione di piani cristallini ad alto indice con atomi di coordinazione insaturi ad alta densità fornisce siti attivi altamente intrinseci. |
Strutture interconnesse con morfologie specifiche (ad esempio, dendriti, nanoframmenti) sopprimono la migrazione delle particelle. |
Moderato (elevato utilizzo di Pt ma costo di sintesi relativamente alto) |
I piani cristallini ad alto indice sono tipicamente instabili nelle condizioni di reazione e si ricostruiscono facilmente in piani a bassa energia; esistono sfide per ottenere una sintesi scalabile e la riproducibilità. |
|
Supporti stabili con forti interazioni metallo-supporto |
Ingegneria del supporto |
I supporti di carbonio drogati possono modulare la struttura elettronica del Pt attraverso effetti elettronici; migliorano il trasferimento di massa. |
Le forti interazioni ancorano le particelle di Pt; i supporti altamente stabili resistono alla corrosione e impediscono il distacco delle particelle. |
Moderate (il costo del vettore può aumentare, ma prolunga la durata di vita). |
Alcuni supporti altamente stabili (ad esempio, gli ossidi metallici) presentano una scarsa conduttività, aumentando potenzialmente la resistenza interfacciale; è necessario un controllo preciso dei meccanismi di interazione metallo-vettore. |
3.2 Soluzioni catalitiche a base di palladio
I catalizzatori a base di palladio (Pd) sono fondamentali nella sintesi chimica fine, in particolare nelle reazioni di cross-coupling e di idrogenazione/ossidazione selettiva. Tuttavia, la loro applicazione pratica è stata costantemente limitata da tre sfide principali: la difficoltà di recuperare e riutilizzare i catalizzatori omogenei di Pd nonostante la loro elevata selettività; i siti attivi non uniformi nei catalizzatori eterogenei di Pd, che portano a problemi come la lisciviazione e la disattivazione indotta dalla sinterizzazione; e la difficoltà significativa di ottenere un controllo preciso sulla selettività chimica, regio- e stereoselettiva. Per affrontare contemporaneamente attività, stabilità e selettività, sono state sviluppate le seguenti strategie avanzate.
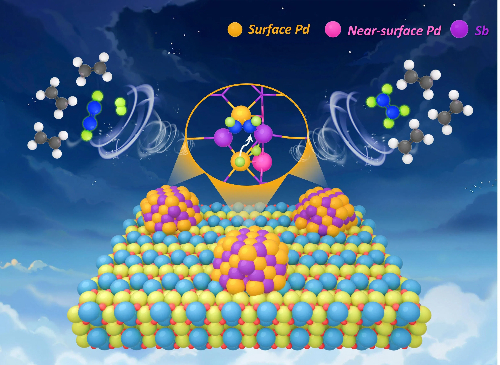
Fig. 8 Catalizzatore a base di palladio: sito di idrogenazione per alcheni
Soluzione 1: catalizzatori a singolo atomo
Questo approccio prevede la stabilizzazione del Pd come atomi isolati per creare siti attivi strutturalmente uniformi, offrendo un percorso ideale verso la massima selettività ed efficienza atomica.
Descrizione della strategia:
Singoli atomi di Pd sono ancorati su supporti ricchi di difetti, come ossidi metallici (CeO2, TiO2), nitruro di carbonio (g-C3N4) o carbonio drogato con azoto (N-C), attraverso metodi che includono un forte adsorbimento elettrostatico, la co-precipitazione o la pirolisi ad alta temperatura.
Meccanismo d'azione:
Massima efficienza atomica e siti attivi uniformi: Ogni atomo di Pd funge da sito attivo indipendente e strutturalmente identico, ottenendo un utilizzo atomico quasi teorico. Questa uniformità elimina le reazioni collaterali causate da siti attivi eterogenei, consentendo una selettività del prodotto target eccezionalmente elevata.
Maggiore stabilità: Le forti interazioni covalenti tra gli atomi di Pd e gli eteroatomi (ad esempio, O, N) sulla superficie del supporto immobilizzano efficacemente le specie di Pd, sopprimendo la migrazione, l'agglomerazione e la lisciviazione, migliorando così la durata catalitica su più cicli.
Soluzione 2: nanocluster e catalisi a confinamento
Questa strategia si concentra sul controllo preciso del numero di atomi di Pd e sullo sfruttamento del confinamento spaziale per personalizzare il comportamento catalitico su scala sub-nanometrica, consentendo una selettività a livello molecolare.
Descrizione della strategia:
I cluster di Pd con nuclearità ben definita (ad esempio, Pd4, Pd8) sono sintetizzati con metodi colloidali o chimici precisi. In alternativa, le specie di Pd sono incapsulate all'interno di strutture porose ordinate di zeoliti o strutture metallo-organiche (MOF) tramite sintesi ship-in-a-bottle.
Meccanismo d'azione:
Effetti di dimensione quantistica: Nella scala dei cluster sub-nanometrici, il Pd presenta strutture elettroniche discrete che differiscono sia dai singoli atomi che dalle nanoparticelle più grandi, portando a proprietà catalitiche uniche e all'attivazione di percorsi di reazione specifici.
Confinamento spaziale e catalisi selettiva della forma: Gli ambienti confinati dei pori delle zeoliti o dei MOF agiscono come nanoreattori che:
Ammettono selettivamente i reagenti e rilasciano i prodotti in base alle dimensioni e alla forma delle molecole (selettività dimensionale),
Limitano le geometrie degli stati di transizione per controllare la stereochimica della reazione (stereoselettività),
isolare fisicamente i cluster di Pd per prevenire l'aggregazione e la crescita.
Soluzione 3: Formazione in situ di nanoparticelle di Pd in fase liquida
Questo approccio sfrutta un sistema catalitico dinamico in cui le specie attive di Pd sono generate in situ, combinando le elevate prestazioni della catalisi omogenea con il facile recupero della catalisi eterogenea.
Descrizione della strategia:
I precursori solubili del Pd (ad esempio, Pd(OAc)2) o i complessi stabilizzati con il ligando vengono introdotti nella miscela di reazione, dove vengono ridotti in situ nelle condizioni di reazione per formare nanoparticelle o nanocluster di Pd altamente attivi sul supporto o nel mezzo liquido.
Meccanismo d'azione:
Sinergia tra catalisi omogenea ed eterogenea: Le nanoparticelle di Pd formate in situ sono piccole, difettose e altamente attive, e assomigliano ai catalizzatori omogenei nelle prestazioni. Dopo la reazione, queste specie possono essere trasformate in forme meno attive o insolubili (ad esempio, attraverso l'ossidazione o l'agglomerazione), consentendo una separazione e un riciclaggio semplici, simili a quelli dei sistemi eterogenei.
Attenuazione della disattivazione: Questo processo dinamico risolve il compromesso stabilità-attività: le piccole particelle altamente attive si formano durante la reazione, mentre uno stato più stabile viene adottato dopo la reazione, riducendo al minimo la sinterizzazione irreversibile e la disattivazione durante il riutilizzo.
Tabella 2 Soluzioni catalitiche a base di palladio Tabella comparativa orizzontale
|
Soluzione |
Strategia di base |
Forza di selettività |
Stabilità Meccanismo |
Utilizzo dell'atomo |
Scenari applicabili |
|
Catalizzatori a singolo atomo |
Dispersione atomica e omogeneizzazione strutturale |
Stereoselettività e chimica |
Forte legame metallo-supporto |
~100% |
Idrogenazione selettiva, ossidazione del CO |
|
Nanocluster e catalisi confinata |
Nuclearità precisa e confinamento spaziale |
Dimensione e stereoselettività |
Il confinamento fisico impedisce l'agglomerazione |
Elevata |
Sintesi chirale, reazioni selettive della forma |
|
Formazione in situ di nanoparticelle di Pd |
Formazione dinamica di specie attive |
Selettività chimica |
L'equilibrio dinamico riduce la sinterizzazione |
Elevata durante la reazione, richiede la riattivazione |
Riciclabile nella sintesi chimica fine |
3.3 Soluzioni catalitiche a base d'oro
L'oro (Au), pur essendo chimicamente inerte nella sua forma massiva, dimostra un'eccezionale attività catalitica quando viene ingegnerizzato su scala nanometrica e adeguatamente supportato: una scoperta trasformativa che ha ridisegnato la catalisi moderna. L'impiego pratico di catalizzatori a base d'oro, tuttavia, deve affrontare tre sfide principali: l'inerzia intrinseca dell'Au sfuso; la forte tendenza delle nanoparticelle di Au a sinterizzare o a subire la maturazione di Ostwald in condizioni di reazione, con conseguente rapida disattivazione; la sensibilità all'umidità e ad alcune specie avvelenanti. Per superare queste limitazioni e sbloccare il pieno potenziale dei nanocatalizzatori di Au, sono state sviluppate diverse strategie di progettazione avanzate, come illustrato di seguito.
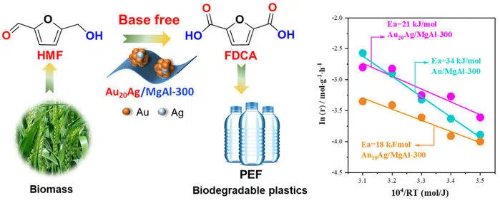
Fig. 9 Catalizzatori a base di oro per la bioconversione
Soluzione 1: Controllo delle dimensioni e ingegneria del supporto
Questo approccio sfrutta gli effetti quantistici e le interazioni con il supporto per attivare le nanoparticelle di Au controllando con precisione le loro dimensioni e lo stato di dispersione.
Descrizione della strategia:
Le nanoparticelle d'oro di dimensioni inferiori a 5 nm - ottimalmente nell'intervallo di 2-3 nm - sono sintetizzate con metodi quali la deposizione-precipitazione o la sintesi colloidale e depositate su supporti di ossido metallico riducibili, tra cui TiO2, Fe2O3 e CeO2.
Meccanismo d'azione:
Effetti della dimensione quantica: Quando la dimensione delle particelle di Au diminuisce al di sotto di ∼5 nm, la sua struttura elettronica passa da metallica a non metallica, dando luogo a un'elevata proporzione di atomi superficiali sotto-coordinati (ad esempio, gradini, bordi). Questi siti mostrano una maggiore capacità di adsorbimento e attivazione di piccole molecole come CO e O2, costituendo l'origine fondamentale dell'attività catalitica dell'Au.
Attivazione mediata dal supporto: Alcuni supporti di ossido metallico non solo stabilizzano le nanoparticelle di Au, ma partecipano direttamente ai cicli catalitici. Ad esempio, nell'ossidazione del CO attraverso il meccanismo di Mars-van Krevelen, l'ossigeno reticolare del supporto (ad esempio, CeO2) reagisce con il CO, mentre l'O2 in fase gassosa reintegra i vacanti di ossigeno, creando un ciclo catalitico sinergico tra Au e il supporto.
Soluzione 2: interfaccia Au-supporto e siti bifunzionali
Questa strategia si concentra sulla progettazione deliberata di siti interfacciali tra le nanoparticelle di Au e il supporto, dove avviene la catalisi sinergica.
Descrizione della strategia:
Attraverso un attento controllo dei parametri di sintesi - come la selezione della sfaccettatura del supporto, la temperatura di calcinazione e l'atmosfera - le nanoparticelle di Au sono finemente disperse per massimizzare la densità e la stabilità dei siti interfacciali Au-supporto.
Meccanismo d'azione:
Catalisi interfacciale bifunzionale: In reazioni chiave come l'ossidazione del CO a bassa temperatura, il sito attivo è spesso situato nel perimetro del supporto di Au. Qui l'Au facilita l'adsorbimento e l'attivazione del CO, mentre il supporto adiacente attiva l'O2 (o l'H2O). Questa divisione spaziale e funzionale del lavoro abbassa significativamente la barriera di attivazione e aumenta la velocità di reazione attraverso un'interazione sinergica.
Soluzione 3: lega e modifica della superficie
Questo approccio migliora sia l'attività che la stabilità dei catalizzatori di Au introducendo un secondo metallo o un ossido modificatore per adattare le proprietà elettroniche e strutturali.
Descrizione della strategia:
L'Au viene legato con altri metalli (ad esempio, Pd, Pt, Ag) o modificato in superficie con ossidi metallici (ad esempio, FeOx, TiOx) per formare nanoparticelle in lega o architetture core-shell e decorate.
Meccanismo d'azione:
Modulazione elettronica: L'introduzione di un secondo elemento altera la densità elettronica degli atomi di Au attraverso gli effetti dei leganti, regolando la forza di adsorbimento degli intermedi ed espandendo la portata della reazione al di là di quanto può fare l'Au puro.
Stabilizzazione strutturale: Il componente secondario agisce come distanziatore fisico, inibendo il contatto diretto e la coalescenza delle particelle di Au durante il trattamento termico o la reazione, migliorando così la resistenza alla sinterizzazione e la longevità operativa.
Tabella 3 Soluzioni catalitiche a base di oro Tabella comparativa orizzontale
|
Soluzioni |
Strategia di base |
Sito attivo |
Meccanismo di miglioramento della stabilità |
Vantaggi |
Sfide principali |
|
Effetto dimensione e selezione del carrier |
Controllo delle dimensioni delle particelle (<5 nm) utilizzando vettori specifici |
Atomi a bassa coordinazione sulla superficie delle piccole particelle di Au; siti di attivazione che partecipano al carrier |
I carrier forniscono siti di ancoraggio, sopprimendo la migrazione delle particelle |
Elevata attività intrinseca, diverse opzioni di carrier e studi approfonditi del meccanismo |
Instabilità termodinamica delle piccole particelle, inclini alla sinterizzazione; forte dipendenza dalle proprietà del carrier |
|
Costruzione dell'interfaccia Au-supporto |
Controllo preciso dell'interfaccia di contatto tra Au e supporto |
Siti a doppia funzione nell'interfaccia Au-Supporto |
Le forti interazioni metallo-supporto stabilizzano le particelle di Au |
Sfruttamento completo degli effetti sinergici tra l'oro e il supporto, con siti attivi ben definiti |
La struttura dell'interfaccia può riconfigurarsi durante le reazioni, il che richiede un'elevata riproducibilità nella preparazione. |
|
Lega e modifica della superficie |
Introduzione di un secondo componente per regolare le strutture elettroniche e geometriche |
Atomi di Au vicino alle superfici delle leghe o agli strati modificati |
Il secondo componente agisce come una barriera fisica, impedendo alle particelle di Au di entrare in contatto con gli strati sinterizzati |
Aumenta contemporaneamente l'attività e la stabilità termica con una forte capacità di regolazione. |
Può introdurre costi o complessità; il secondo componente può segregarsi o lisciviarsi. |
4 Confronto completo e prospettive
4.1 Confronto completo
Attraverso un'analisi approfondita dei tre principali catalizzatori di metalli preziosi - platino (Pt), palladio (Pd) e oro (Au) - possiamo riassumere sistematicamente le loro caratteristiche e soluzioni, distillando i principi di progettazione comuni e le direzioni di sviluppo future.
Tabella 4 Confronto completo dei tre catalizzatori di metalli preziosi
|
Materiale |
Applicazione principale |
Problema principale |
Soluzione principale |
Effetto e caratteristiche |
|
Pt |
Elettrocatalisi |
Costo, attività, stabilità |
Leghe/Core-Shell/Controllo della morfologia |
Potenziamento dell'attività intrinseca, riduzione del dosaggio |
|
Pd |
Sintesi chimica |
Selettività, recupero, disattivazione |
Atomo singolo/Cluster/Confinato |
Consente una sintesi precisa e una facile separazione |
|
Au |
Catalisi ambientale |
Intrinsecamente inerte, soggetto a sinterizzazione |
Controllo delle dimensioni/Interfaccia |
Attiva le prestazioni, migliora la stabilità termica |
4.2 Estrazione dei principi universali di progettazione
Sebbene i tre catalizzatori debbano affrontare sfide diverse, le loro soluzioni rivelano principi comuni nella progettazione dei materiali catalitici:
L'ingegneria interfacciale è universalmente critica: che si tratti di interfacce Pt-supporto, Au-supporto o Pd-supporto, queste regioni sono fondamentali per costruire una catalisi sinergica, migliorare le interazioni metallo-supporto e migliorare la stabilità. Le interfacce sono il principale campo di battaglia per superare i limiti dei singoli materiali.
La modulazione della struttura elettronica è fondamentale per migliorare l'attività intrinseca: La modulazione dei centri in banda d dei siti attivi attraverso leghe, drogaggio, ingegneria delle deformazioni e altri mezzi per ottimizzare le barriere energetiche di adsorbimento/desorbimento per gli intermedi di reazione rappresenta una strategia universale per superare i colli di bottiglia dell'attività catalitica.
Il controllo della struttura geometrica è un potente strumento per stabilizzare i catalizzatori e regolare la selettività: Il controllo preciso della disposizione geometrica dei siti attivi - da singoli atomi e nanocluster a piani cristallini ad alto indice - può contemporaneamente migliorare l'attività aumentando il numero di atomi a bassa coordinazione e orientando con precisione i percorsi di reazione e la selettività attraverso gli effetti di ostacolo sterico e confinamento.
4.3 Prospettive future
In prospettiva, la ricerca sui catalizzatori di metalli preziosi sta entrando in una nuova fase caratterizzata da una profonda integrazione multidisciplinare, approcci basati sui dati e una forte enfasi sullo sviluppo sostenibile.
L'integrazione tra i sistemi di materiali e l'impollinazione incrociata delle filosofie di progettazione emergeranno come direzioni chiave. Ad esempio, l'applicazione del concetto maturo di struttura core-shell dei catalizzatori a base di platino ai sistemi a base di palladio potrebbe ridurre ulteriormente il consumo e i costi dei catalizzatori. In alternativa, l'impiego di sofisticate strategie di ingegneria interfacciale dai catalizzatori a base di oro per migliorare la durata degli elettrocatalizzatori a base di platino potrebbe produrre nuovi sistemi catalitici ad alte prestazioni attraverso questa fertilizzazione incrociata di idee.
L'evoluzione sinergica dell'intelligenza artificiale e delle tecniche di caratterizzazione avanzate trasformerà profondamente i paradigmi di ricerca e sviluppo: Da un lato, l'apprendimento automatico consentirà uno screening virtuale ad alto rendimento, identificando rapidamente le soluzioni ottimali da vaste combinazioni di composizione, struttura e supporti per ottenere una "personalizzazione on-demand" dei catalizzatori. Dall'altro lato, i progressi nelle tecniche di caratterizzazione in situ/operative, come la radiazione di sincrotrone e la microscopia elettronica a scansione ambientale, consentiranno l'osservazione su scala atomica in tempo reale dell'evoluzione strutturale dinamica negli ambienti di reazione reali. Questo approccio unificato rivelerà la natura dei siti attivi e dei meccanismi di disattivazione, guidando una progettazione razionale più mirata.
In definitiva, tutti questi progressi tecnologici devono servire il grande obiettivo dello sviluppo sostenibile. Ciò significa che le tecnologie di riciclaggio ecologico dei metalli preziosi e la creazione di sistemi economici circolari diventeranno altrettanto importanti della progettazione delle prestazioni dei catalizzatori stessi. Allo stesso tempo, lo sviluppo di catalizzatori alternativi a bassissimo carico di metalli preziosi o addirittura di alternative completamente prive di metalli preziosi sarà il percorso fondamentale per affrontare le limitazioni delle risorse e raggiungere uno sviluppo a lungo termine nei settori della chimica e dell'energia.

Fig. 10 Applicazioni dei catalizzatori di metalli preziosi
Partner per soluzioni catalitiche avanzate
Stanford Advanced Materials (SAM) fornisce catalizzatori e supporti di Pt, Pd e Au di elevata purezza, su misura per le vostre esigenze di R&S e industriali. Contattate il nostro team tecnico per discutere di soluzioni personalizzate.
Riferimento
[1] Zandkarimi, B.; Poths, P.; Alexandrova, A. N. When Fluxionality Beats Size Selection: Accelerazione della maturazione di Ostwald di cluster sub-nano. Angew. Chem. Int. Ed. 2021, *60* (11), 5701-5704. DOI: 10.1002/anie.202100107.
[2] Zhang, S.; Han, Y.; Zhu, B.; Gao, Y. Particle Hopping and Coalescence of Supported Au Nanoparticles in Harsh Reactive Environments. J. Am. Chem. Soc. 2025. DOI: 10.1021/jacs.5c03633.
[3] Liu, L.; Lu, J.; Wang, L.; Xiao, F.-S. La zeolite Beta dealluminata inverte la maturazione di Ostwald per ottenere catalizzatori durevoli a base di nanoparticelle di rame. Science 2023, *382* (6673), 771-776. DOI: 10.1126/science.adj1962.
[4] Li, W.; Ouyang, R. Stability of Nanocatalysts under Reaction Conditions: Uno studio teorico. J. Am. Chem. Soc. 2013, *135* (5), 1760-1771. DOI: 10.1021/ja3087054.
[5] Li, W., & Ouyang, R. (2013). Stabilità dei nanocatalizzatori in condizioni di reazione: Uno studio teorico. Journal of the American Chemical Society, 135(5), 1760-1771. DOI: 10.1021/ja3087054.
[6] Yin, P., Hu, S., Liang, H., & Li, W. (2021). Quantificazione della distanza critica delle particelle per mitigare la sinterizzazione dei catalizzatori. Nature Communications, 12, 4865. DOI: 10.1038/s41467-021-25116-2.

 Bar
Bar
 Perline e sfere
Perline e sfere
 Bulloni e dadi
Bulloni e dadi
 Crogioli
Crogioli
 Dischi
Dischi
 Fibre e tessuti
Fibre e tessuti
 Film
Film
 Fiocco
Fiocco
 Schiume
Schiume
 Lamina
Lamina
 Granuli
Granuli
 Nidi d'ape
Nidi d'ape
 Inchiostro
Inchiostro
 Laminato
Laminato
 Grumi
Grumi
 Maglie
Maglie
 Film metallizzato
Film metallizzato
 Piatto
Piatto
 Polveri
Polveri
 Asta
Asta
 Lenzuola
Lenzuola
 Cristalli singoli
Cristalli singoli
 Bersaglio di sputtering
Bersaglio di sputtering
 Tubi
Tubi
 Lavatrice
Lavatrice
 Fili
Fili
 Convertitori e calcolatori
Convertitori e calcolatori
 Scrivi per noi
Scrivi per noi



 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


