Il litio: Proprietà e usi dell'elemento
Capire il litio come elemento
Che cos'è il litio?
Il litio, numero atomico 3 e simbolo Li, è il metallo più leggero della tavola periodica e un metallo alcalino. Durante i due secoli della sua esistenza come curiosità di laboratorio, il litio si è evoluto in un bene industriale commercializzato a livello globale. Oggi, la raffinazione e la produzione di litio - attraverso l'elettrolisi del sale o la macinazione di minerali come lo spodumene - sono alla base di un'industria multimiliardaria nel settore dell'accumulo di energia, dell'esplorazione spaziale e dell'elettronica.

Descrizione delle proprietà chimiche
Le proprietà chimiche dellitio rispecchiano le sue proprietà fisiche e sono altrettanto distinte:
-Reattività: Il litio reagisce vigorosamente con l'acqua per formare idrossido di litio (LiOH) e idrogeno gassoso. Ad esempio, un piccolo pezzo di litio immerso in acqua può sviluppare un'effervescenza visibile in pochi secondi.
-Natura alcalina: Essendo un altro metallo alcalino, il litio cede prontamente il suo elettrone esterno per produrre lo ione Li⁺, diventando così un importante protagonista delle reazioni elettrochimiche, anche nelle batterie agli ioni di litio.
- Infiammabilità: Il litio si infiamma con una caratteristica fiamma rossa, che gli ingegneri devono tenere presente quando lavorano e conservano il litio sfuso.
Tabella dei dati sulle proprietà fisiche
|
Proprietà |
Valore |
|
Numero atomico |
3 |
|
Peso atomico |
6,94 g/mol |
|
Punto di fusione |
180.54 °C |
|
Punto di ebollizione |
1590 °C |
|
Densità |
0,534 g/cm³ |
|
Aspetto |
Metallo bianco-argenteo |
|
Durezza |
Morbida |
|
Conducibilità elettrica |
Alta |
|
Conduttività termica |
Alta |
Scoperta del litio
Il litio fu scoperto per la prima volta nel 1817 nella petalite, un'isola di Utö, in Svezia. L'analisi di Arfvedson rivelò un nuovo elemento non identificato con proprietà diverse dal sodio o dal potassio. Il litio metallico fu successivamente separato, tramite elettrolisi dei sali di litio, in modo che scienziati e ingegneri potessero analizzarne ulteriormente le proprietà fisiche e chimiche. Nel corso del tempo, la strana combinazione di leggerezza, alta reattività e potenziale elettrochimico del litio lo ha portato su una traiettoria che va dall'accumulo di energia ai grassi industriali e alla medicina.
Leghe e composti del litio
- Leghe litio-alluminio: Estremamente leggere e dure, utilizzate nei componenti degli aerei e delle auto sportive.
- Leghe litio-rame: Conferiscono una maggiore conduttività elettrica, spesso utilizzate nei connettori e nei circuiti elettronici.
- Fosfato di litio e ferro (LiFePO₄): Comune nei catodi delle batterie per auto elettriche grazie alla stabilità e alla lunga durata dei cicli.
- Idrossido di litio (LiOH) e carbonato (Li₂CO₃): Di importanza fondamentale nelle batterie di ricarica, nei grassi lubrificanti e nei processi chimici industriali.
- Cloruro di litio (LiCl): Utilizzato in essiccanti, condizionatori d'aria e sintesi chimica.
Ad esempio, Tesla e altri produttori di veicoli elettrici utilizzano batterie al litio-ferro fosfato (LFP) in alcune flotte di auto, dove la stabilità termica e la densità energetica sono fondamentali per garantire sicurezza e funzionalità.
Applicazioni comuni
Le applicazioni del litio sono varie:
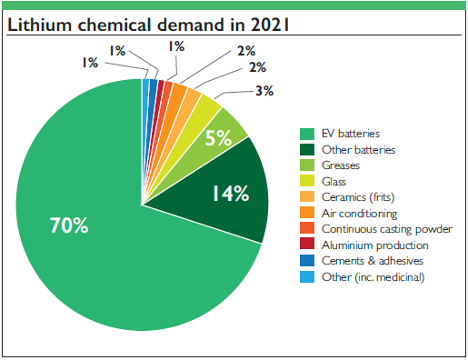
1. Batterie: Le batterie agli ioni di litio e ai polimeri di litio dominano il mercato dell'elettronica portatile, dei veicoli elettrici e dei sistemi di accumulo di energia rinnovabile grazie alla loro elevata densità energetica.
2. Leghe: Il litio alleggerisce le leghe di alluminio e rame, migliorando l'efficienza aerospaziale senza perdere in resistenza.
3. Usi medicinali: Il carbonato di litio stabilizza i pazienti affetti da disturbo bipolare, dimostrando l'impatto del litio al di là degli usi industriali.
4. Vetro e ceramica resistenti al calore: Il litio aumenta la resistenza agli shock termici e la forza.
5. Grassi lubrificanti: I grassi al litio hanno buone prestazioni a temperature e pressioni elevate, essenziali nell'industria manifatturiera e automobilistica.
 [1]
[1]
Processi di preparazione
Il litio si ottiene principalmente attraverso:
1. Il litio metallico viene recuperato da LiCl o LiF mediante elettrolisi per ottenere un'elevata purezza per le applicazioni di mercato.
2. Estrazione di minerali: Lo spodumene e la petalite vengono lavorati per formare carbonato o idrossido di litio da utilizzare per la produzione di batterie e prodotti chimici.
Domande frequenti
Quali sono le applicazioni più frequenti del litio?
Principalmente nelle batterie ricaricabili, nelle leghe leggere, nei grassi lubrificanti e nei prodotti farmaceutici.
Come si estrae il litio?
Attraverso l'elettrolisi dei sali di litio o da minerali di spodumene.
Il litio è reattivo?
Sì, soprattutto con l'acqua, formando LiOH e idrogeno gassoso.
Cosa sono le batterie agli ioni di litio?
Forniscono energia a smartphone, computer portatili, veicoli elettrici e sistemi di accumulo di energia rinnovabile grazie all'elevata densità energetica e alla lunga durata del ciclo.
Riferimenti:
[1] Associazione Internazionale del Litio (2023, 13 ottobre). Litio 101. Recuperato il 17 luglio 2025, da https://lithium.org/lithium-101/.

 Bar
Bar
 Perline e sfere
Perline e sfere
 Bulloni e dadi
Bulloni e dadi
 Crogioli
Crogioli
 Dischi
Dischi
 Fibre e tessuti
Fibre e tessuti
 Film
Film
 Fiocco
Fiocco
 Schiume
Schiume
 Lamina
Lamina
 Granuli
Granuli
 Nidi d'ape
Nidi d'ape
 Inchiostro
Inchiostro
 Laminato
Laminato
 Grumi
Grumi
 Maglie
Maglie
 Film metallizzato
Film metallizzato
 Piatto
Piatto
 Polveri
Polveri
 Asta
Asta
 Lenzuola
Lenzuola
 Cristalli singoli
Cristalli singoli
 Bersaglio di sputtering
Bersaglio di sputtering
 Tubi
Tubi
 Lavatrice
Lavatrice
 Fili
Fili
 Convertitori e calcolatori
Convertitori e calcolatori
 Scrivi per noi
Scrivi per noi




 Chin Trento
Chin Trento



